
【题目】室温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )

A.溶液中的氢离子浓度:a<b
B.盐酸的物质的量浓度为0.0100mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00mL时(忽略反应前后体积变化),该混合液的pH=1+lg3
【答案】D
【解析】
A.a点时加入NaOH较少,溶液中c(H+)较大,则氢离子浓度:a>b,故A选项错误。
B.加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱)可知,盐酸的物质的量浓度为0.1000mol/L,故B选项错误。
C.指示剂为酚酞,溶液变色范围为pH为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故C选项错误。
D.当滴加NaOH溶液10.00 mL时,酸过量,c(H+)=(0.02L×0.1mol/L-0.01L×0.1mol/L)÷0.03L=![]() ×10-1mol/L,则pH=1+lg3,故D选项正确。
×10-1mol/L,则pH=1+lg3,故D选项正确。
故答案选D。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
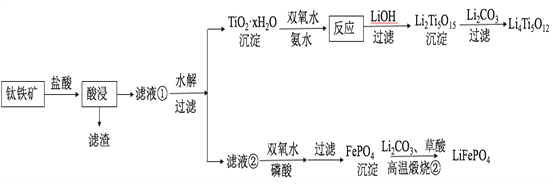
回答下列问题:
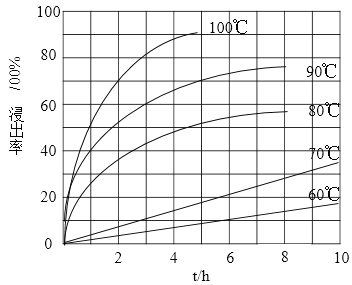
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在加热条件下进行的反应不一定是吸热反应
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3稳定
D.已知,H2(g)的燃烧热是H=-285.8kJ/mol,则2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,b为阴极。同时a、d电极上产生气泡。试回答

(1)a连接电源的___极。b极的电极反应式为______。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:___________。此时C极上的电极反应式为:_________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上的电极反应式为___________,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 ______ 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.熵减的吸热反应可能是自发反应
B.需要加热的化学反应,生成物的总能量一定高于反应物的总能量
C.使用催化剂既不会改变反应的限度又不会改变反应的焓变
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。

①下列条件可以判定反应到达平衡状态的是____(填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。

①α(CO)随温度升高而减小的原因是____。
②图中压强p1、p2、p3中最大的是____。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积固定的容器中,反应xA(g)+yB(g)![]() zH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知x+y=2z,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
zH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知x+y=2z,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少D.amol/L<c(A)<2amol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com