
���� ��1��С�մ���̼�����Ƶ��׳ƣ�θ����Ҫ�����ᣬ���߷�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��
��2������Ƥ�к���̼��ƣ�̼��ƿ����к����
��3��������̼�����Ʒ�Ӧ�������壬����������������Ӧ�����Ȼ�����ˮ��
��4���������ƾ��к�ǿ�ĸ�ʴ�ԣ�
��� �⣺��1��С�մ�ΪNaHCO3��θ���к����ᣬ��С�մ�����θ�����Ļ�ѧ����ʽΪ��NaHCO3+HCl�TNaCl+H2O+CO2����������̼��ˮд��ѧʽ�����ӷ�ӦΪH++HCO3-�TH2O+CO2����
�ʴ�Ϊ��H++HCO3-�TH2O+CO2����
��2������Ƥ�к���̼��ƣ�̼��ƿ����к����ᣬ�Ӷ�������θ������Ŀ�ģ����ӷ���ʽΪCaCO3+2H+=Ca2++H2O+CO2����
�ʴ�Ϊ��̼��ƣ�CaCO3+2H+=Ca2++H2O+CO2����
��3��������̼�����Ʒ�Ӧ�������壬���á�С�մ�Ƭ�������ܻ����θ������θ���ף�������������������Ӧû���������ɣ����ӷ�ӦΪAl��OH��3+3H+�TAl3++3H2O��
�ʴ�Ϊ��Al��OH��3+3H+�TAl3++3H2O��
��4����������Ҳ���к�θ�ᣬ���������ƾ��к�ǿ�ĸ�ʴ�ԣ���˲��ɷ���������������������θ����ಡ��
�ʴ�Ϊ�������ԣ�
���� ���⿼�鿹��ҩ����Ҫ�ɷֺ���Ч���漰���ӷ�Ӧ����ʽ����д����ϤԪ�ؼ�����Ҫ����������ʡ�������д���ӷ���ʽ�ķ����Ͳ����ǽ��Ĺؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4�� | B�� | 5�� | C�� | 6�� | D�� | 7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ���ڵĢ�A�����A��Ԫ�ص�ԭ������һ�����1 | |
| B�� | þ������ͭ�����������ֽ���Ԫ���У�ͭ�������ڹ���Ԫ�� | |
| C�� | Ԫ�صķǽ�����Խǿ������̬�⻯��ˮ��Һ������Խǿ | |
| D�� | �������ڷǽ���Ԫ�غ���������Դ�����������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
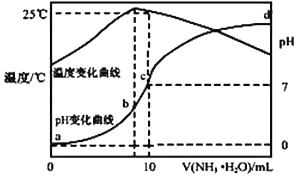 ��ij�¶�ʱ���� n mol•L-1��ˮ���� 10mL 1.0mol•L-1 �����У���Һ pH ���¶�����백 ˮ����仯������ͼ��ʾ�������й�˵����ȷ���ǣ�������
��ij�¶�ʱ���� n mol•L-1��ˮ���� 10mL 1.0mol•L-1 �����У���Һ pH ���¶�����백 ˮ����仯������ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | a �� Kw=1.0��10-14 | |
| B�� | ˮ�ĵ���̶ȣ�b��c��a��d | |
| C�� | b �㣺c��NH4+����c��Cl-����c��H +����c��OH -�� | |
| D�� | 25��ʱ NH4Cl ˮ�ⳣ��Ϊ��10n-1����10-7mol•L-1���� n ��ʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com