
【题目】下列反应中加入氧化剂才能进行的是
A. CO32-→CO2 B. Zn2+→Zn C. H 2→H2O D. CuO→Cu
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(一)铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第___族,其基态原子中未成对电子的个数为_________。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________,尿素分子中C、N原子的杂化方式分别是_____、___,其分子中σ键与π键的数目之比为___,所含非金属元素的电负性由大到小的顺序是_______。
(二)已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_____________。
(2)砷与氢元素。可形成化合物砷化氢,该化合物的空间构型为_____,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置___(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置___。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为____。
(3)装置A中①的名称是_____,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是______。
(4)粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④过滤 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发,操作顺序合理的是_____(选填项字母)
a.⑤②③①④⑥⑦ b.⑤①②③④⑥⑦ c.⑤②①③⑥④⑦ d.⑤③②①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1834年,德国科学家米希尔里希通过蒸馏安息香酸(苯甲酸)和石灰的混合物得到一种液体物质,将其命名为苯。
(1)分子式为C6H6的有机化合物有多种同分异构体。写出符合下列条件的苯的同分异构体。
①分子式为C6H6,含有一个叁键,其余为双键,且叁键、双键均不相邻的无支链的结构简式:__________________________(写一个即可,下同)。
②分子式为C6H6,含有2个四元环的结构简式__________________________________。
③分子式为C6H6,含有多元环的结构简式_____________________________________。
(2)苯乙烯在常温下用镍做催化剂与氢气加成得到乙苯,很难得到乙基环已烷,这说明:___________________________________________________。
(3)1866年凯库勒提出了苯的单键、双键 交替的正六边形平面结构,解释了苯的部分性质。请你用一些事实说明:苯环上的化学键不是一般的碳碳单键和碳碳双键,而是介于一种碳碳单键和碳碳双键之间的特殊键。如:__________,__________,_____________,(至少填3 种不同类的事实)。
(4)甲苯是苯的同系物。写出下列反应的化学方程式:
①甲苯与溴单质在光照条件下发生反应______________________;
②甲苯与混酸发生硝化反应_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中含Cl-物质的量浓度最大的是
A. 20mL0.2mol/L的AlCl3溶液 B. 40mL0.2mol/L的CaCl2溶液
C. 60mL0.4mol/L的KCl溶液 D. 100mL0.4mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 主族元素的电负性越大,元素原子的第一电离能一定越大
B. 在元素周期表中,元素电负性从左到右越来越大
C. 金属元素电负性一定小于非金属元素电负性
D. 在形成化合物时,电负性越小的元素越容易显示正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:![]() 。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
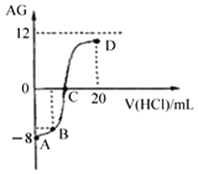
A. 该滴定过程可选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 溶液中由水电离的c(H+):C点>D点
D. 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+c(H+)= c(MOH)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeS04[含A12(S04)3和少量重金属离子]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)滤液经处理可得到副产品________,可作肥料。
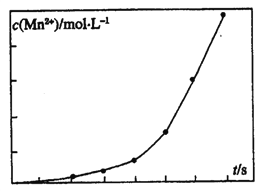
(3)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为_________。
(4)实验室测定高纯超微细草酸亚铁组成的步骤依次为
步骤1:准确称量一定量草酸亚铁样品,加入的H2S04溶解。
步骤2:用0.200 0molL-1标准KMn04溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2gZn粉和5mL2molL-1的H2S04溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMn04溶液滴定,消耗溶液10.00 mL.
计算样品中C2O42-的物质的量_________________。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com