
已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
只给出下列甲和乙中对应的量,不能求出物质的量的是( )
ABCD
甲物质的粒子数标准状况下的气体摩尔体积固体的体积溶液中溶质的物质的量浓度
乙阿伏加德罗常数标准状况下的气体体积固体的密度溶液的体积
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:选择题
下列是部分矿物资源的利用及产品流程,有关说法不正确的是( )
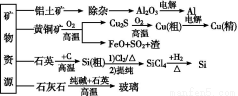
A.粗铜电解精炼时,粗铜作阳极
B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
常温常压下,将a mol CO2气体通入1 L b mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
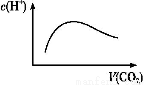
A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH-)+c(C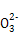 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(C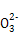 )>c(OH-)>c(HC
)>c(OH-)>c(HC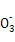 )>c(H+)
)>c(H+)
D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(C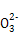 )+c(HC
)+c(HC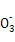 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为 ;②达到平衡时反应放出的热量为 ;③此温度下该反应的平衡常数K= 。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
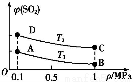
①温度关系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA KB,KA KD。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定温度下,在固定容积的密闭容器中发生下列反应:2HI H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:选择题
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是( )
A.原子半径:丙>乙>甲
B.最外层电子数:丙=丁
C.气态氢化物的稳定性:甲>丙
D.最高价氧化物对应的水化物的酸性:丁>甲
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:填空题
氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
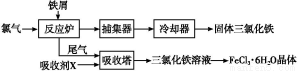
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
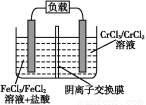
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+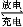 Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题14有机化学基础选修5练习卷(解析版) 题型:选择题
化合物M是香豆素类天然化合物,对化合物M的叙述错误的是( )

A.M的分子式为C12H10O5
B.1 mol M最多可和6 mol H2发生加成反应
C.M可发生水解反应
D.M可与HBr反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com