
| A. | Kw>1×10-14 | B. | 水电离的c(H+)>1×10-13 mol/L | ||
| C. | pH>13 | D. | c(OH-)=c(H+)+c(Na+) |
科目:高中化学 来源: 题型:选择题
| A. | 钴的一种核素 | B. | 质子数为27 | C. | 核外电子数为27 | D. | 中子数为60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
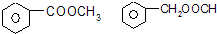 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
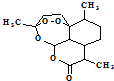 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).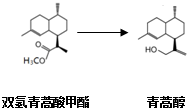
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
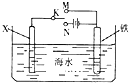
| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com