
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol/L) | 6 | 3 | 2 | 2 |
c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO-![]() 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与安全有关的说法正确的是
A. 碘是人体必需微量元素,所以要多吃富含高碘酸的食物
B. 易燃试剂与强氧化性试剂分开放置并远离火源
C. 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤
D. 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第3周期中,置换酸中氢的能力最强的元素的元素符号为 , 化学性质最稳定的元素符号是 , 最高价氧化物的水化物的酸性最强的化合物的化学式是 , 最高价氧化物的水化物的碱性最强的化合物的化学式是 , 显两性的氢氧化物的化学式是 , 该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为、 , 原子半径最大的金属元素的名称是 , 离子半径最小的离子结构示意图是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,放电时其电池反应如下:PbO2+Pb+2H2SO4== 2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是
A.Pb是正极 B.PbO2得电子,被氧化
C.负极反应是Pb+SO42——2e—== PbSO4D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是( )
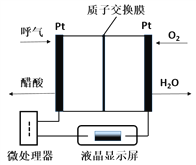
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 ![]() 2NO2 △H>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算0~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)40s时,NO2的的浓度b=_______mol/L,反应最迟到________s到达平衡状态
(4)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有___________(填序号)。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com