
【题目】在容积为![]() 的密闭容器内,物质D在
的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
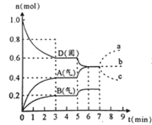
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
B.该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C.已知:反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线
【答案】A
【解析】
A. B物质的平均反应速率为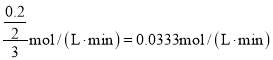 ,故A错误;
,故A错误;
B. 根据图在第一次达到平衡时A的物质的量增加了![]() ,B的物质的量增加了
,B的物质的量增加了![]() ,所以A、B为生成物,D的物质的量减少了
,所以A、B为生成物,D的物质的量减少了![]() ,所以D为反应物,D、A、B的变化量之比为
,所以D为反应物,D、A、B的变化量之比为![]() :
:![]() :
:![]() :2:1,反应中各物质计量数之比等于物质的浓度的变化量之比,可写出化学方程式为
:2:1,反应中各物质计量数之比等于物质的浓度的变化量之比,可写出化学方程式为![]() ,由于D是固体,所以平衡常数表达式为
,由于D是固体,所以平衡常数表达式为![]() ,故B正确;
,故B正确;
C. 第5分钟时,A、B的物质的量在原来的基础上增加,而D的物质的量在原来的基础上减小,说明平衡正向移动,由于反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度,故C正确;
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度,故C正确;
D. 由于D是固体,量的改变不影响化学平衡,所以A的物质的量不变,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】对氮及其化合物的研究具有重要意义。
(1)对于2NO(g)+O2(g) ![]() 2NO2(g)反应包含以下两个基元反应:
2NO2(g)反应包含以下两个基元反应:
① 2NO(g) ![]() N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
② N2O2(g)+O2(g) ![]() 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
(2)使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
副反应:4NH3(g)+4O2 (g) ![]() 2N2O (g)+6H2O (g) △H<0
2N2O (g)+6H2O (g) △H<0
下表在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度。
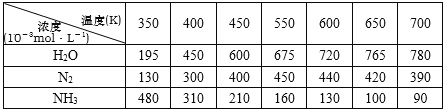
N2浓度变化趋势___________________,试解释原因______________________,
根据表中数据推测,副反应开始发生的温度区间是_____________________。
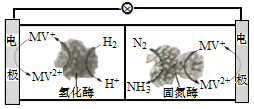
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。请写出氮气在固氮酶作用下发生的化学反应_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠是重要的化工原料,常用作还原剂、防腐剂、去氯剂等。回答下列问题:
(1)要配制250mL0.5mol/L的Na2SO3溶液,需要用托盘天平称取Na2SO3·7H2O晶体________g。配制溶液所用到的玻璃仪器有:玻璃棒、烧杯、量筒和_________________。
(2)配制过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是________。
(3)下列操作会使所配溶液浓度偏高的是________。
A.所选用的溶质已经失去部分结晶水 B.亚硫酸钠晶体与砝码位置放反了
C.转移溶液时玻璃棒靠在刻度线上方 D.定容时俯视容量瓶的刻度线
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切
(4)Na2SO3放在空气中容易被氧化变质。检验Na2SO3溶液是否变质的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质存在转化关系:A+B→C+D+H2O,其中C属于盐类,下列推断不正确的是
A.若A为黄绿色气体,则D可能有漂白性
B.若A为红色金属单质,则D一定是红棕色气体
C.若A为纯碱,则D一定能使澄清石灰水变浑浊
D.若A为氯化铵,则D一定是具有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究 NH3的还原性实验,按如图装置进行实验。
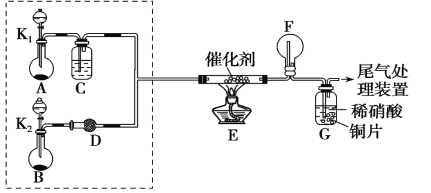
A、B 装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中_________。(填 A 或 B)
(2)NH3 催化氧化的化学方程式是___________。
(3)甲乙两同学分别按上述装置进行实验。甲观察到装置 F 中有红棕色气体,乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)___________。
(4)该小组还利用如图所示装置探究 NH3 能否被 NO2 氧化(K1、K2为止水夹,夹持固定装置略去)。
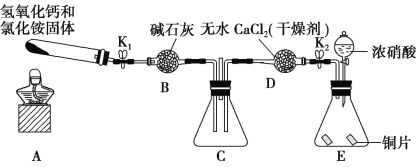
A中发生反应的化学方程式为____________。
(5)若在 C 装置中 NH3 能被 NO2 氧化全部生成无毒物质,假设此反应转移电子 0.4mol,则消耗标准状况下的 NO2__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料合成聚合物PMA和聚碳酸酯PC的路线如下:

回答下列问题:
(1)下列关于高分子化合物的说法中正确的是________。(填标号)
a.聚乙烯分子中含有碳碳双键
b.![]() 的单体是2-丁炔
的单体是2-丁炔
c.棉花、羊毛和蚕丝是天然纤维
d.CuSO4溶液可使蛋白质变性
(2)A的化学名称是________,C中的官能团名称为_________。
(3)①的反应类型为________,③的反应类型为________。
(4)反应②的化学方程式为_____________________。
(5)B的同系物C5H8O2共有____________种同分异构体(不含立体异构),写出其中核磁共振氢谱为三组峰的物质的结构简式:______________。
(6)参照上述合成路线,以CH3CHO为原料(无机试剂任选),设计制备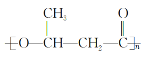 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色冶金工业中除了铁、锰、铬、钒、钛以及这些金属的黑色金属合金以外,其他的金属,都算是有色金属。
![]() 基态钛原子的结构示意图为________;基态铬原子的价层电子排布式为________。
基态钛原子的结构示意图为________;基态铬原子的价层电子排布式为________。
![]() 中C、N的电负性关系为C________
中C、N的电负性关系为C________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的沸点比
的沸点比![]() 的沸点低,其原因是________。
的沸点低,其原因是________。
![]() 中C原子的杂化方式为________;
中C原子的杂化方式为________;![]() 分子是________
分子是________![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子;
分子;![]() 分子中
分子中![]() 键与
键与![]() 键的数目之比为________。
键的数目之比为________。
![]() 金属锰的一种晶体为面心立方最密堆积,其晶胞中有________个锰原子,每个锰原子周围紧邻的锰原子有________个。
金属锰的一种晶体为面心立方最密堆积,其晶胞中有________个锰原子,每个锰原子周围紧邻的锰原子有________个。
![]() 因
因![]() 和
和![]() 外围有较多能量相近的空轨道,故能与一些分子或离子形成配合物。如图为普鲁士蓝配合物晶体结构的示意图
外围有较多能量相近的空轨道,故能与一些分子或离子形成配合物。如图为普鲁士蓝配合物晶体结构的示意图![]() 每两个立方体中,一个
每两个立方体中,一个![]() 在其中一个立方体中心,另一个则无
在其中一个立方体中心,另一个则无![]() ,其化学式是________。
,其化学式是________。
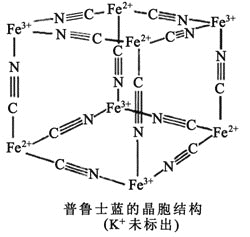
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com