
【题目】有关下列两种溶液的说法中,正确的是( )
溶液①:0.2 mol·L-1CH3COONa溶液;溶液②:0.1 mol·L-1H2SO4溶液
A. 相同温度下,溶液中水的电离程度:溶液①<溶液②
B. 加水稀释溶液①,溶液中![]() 变大
变大
C. 等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO![]() )=c(Na+)
)=c(Na+)
D. 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO![]() )
)
【答案】D
【解析】A. ①促进水的电离,②抑制水的电离,所以相同温度下,溶液中水的电离程度:溶液①>溶液②,故A错误;B. 加水稀释溶液①,溶液中水解常数![]() 不变,故B错误;C. 等体积混合溶液①和溶液②,发生反应:CH3COO-+H+=CH3COOH,所得溶液呈酸性,其中电荷守恒:c(CH3COO-)+2c(SO
不变,故B错误;C. 等体积混合溶液①和溶液②,发生反应:CH3COO-+H+=CH3COOH,所得溶液呈酸性,其中电荷守恒:c(CH3COO-)+2c(SO![]() )+ c(OH-)=c(Na+)+c(H+),由于c(OH-)<c(H+),所以c(CH3COO-)+2c(SO
)+ c(OH-)=c(Na+)+c(H+),由于c(OH-)<c(H+),所以c(CH3COO-)+2c(SO![]() )<c(Na+),故C错误;D. 电荷守恒:c(CH3COO-)+2c(SO
)<c(Na+),故C错误;D. 电荷守恒:c(CH3COO-)+2c(SO![]() )+ c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以c(CH3COO-)+2c(SO
)+ c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以c(CH3COO-)+2c(SO![]() )=c(Na+),c(Na+)>c(SO
)=c(Na+),c(Na+)>c(SO![]() ),故D正确。故选D。
),故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法不正确的是
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值。下列说法正确的是( )
A. 1molNa2O2固体中含离子总数为4 NA
B. 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
C. 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA
D. 常温下,1mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于化学、国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。回答下列问题:
(1)浓硝酸不稳定,易分解,需要保存在棕色细口瓶,并用________(填“玻璃”或“橡胶”)塞盖好,该分解的化学方程式为_______________________。
(2)将红热的木炭投入热的浓硝酸中,看到的现象是______________________。写出该反应的化学方程式______________________________。
(3)写出氨水与稀盐酸反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图:
回答下列问题:
(1)从反应开始到10s时,用Z表示的反应速率为_______, X的物质的量浓度减少了___________,Y的转化率为______________。
(2)该反应的化学方程式为_________________________。
(3) 10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______________。
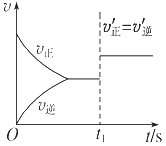
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A. 1molOH-所含质子数为10NA
B. 常温常压下,28gCO和N2的混合气体所含原子数为2NA
C. 4g氦气含有的原子数为2NA
D. 标准状况下,11.2L酒精含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车人员体内酒精含量的检测装置如图所示,下列说法不正确的是

A.该检测装置实现了将化学能转化了电能,且单位时间内通过电量越大,酒精含量越高
B.电极A 的反应:H2O+C2H5OH-4e-=CH3COOH+4H+
C.电极B 是正极,且反应后该电极区pH值减小
D.电池反应:O2 +C2H5OH = CH3COOH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
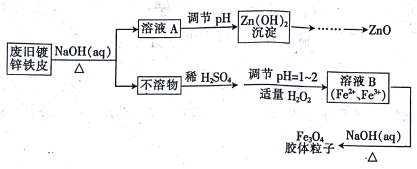
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com