
【题目】下列元素的原子核外电子排布中,最外层与次外层上的电子数相等的是
A. 氦 B. 氩 C. 镁 D. 氧
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
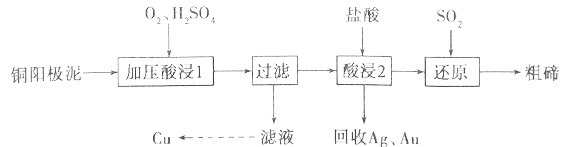
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氮化合物的性质叙述正确的是( )
A.可用铁制容器储存稀硝酸
B.实验室用排空气集气法收集NO气体
C.实验室可用氨水与硫酸铝溶液反应制取氢氧化铝
D.NO2与水发生化合反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率 B. 实验室用排饱和食盐水法收集氯气
C. 打开汽水瓶盖,即有大量氕泡逸出 D. 温度升高,纯水中的H+浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(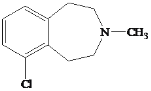 )是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
)是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
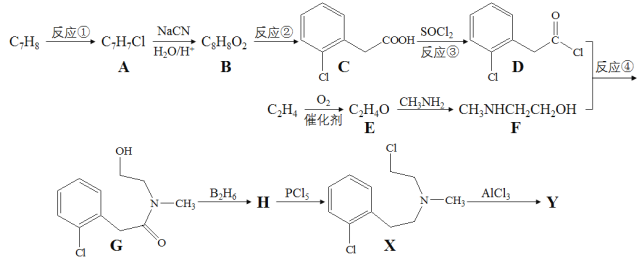
已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH
请回答:
(1)写出化合物H的结构简式_______________。
(2)下列说法不正确的是______________。
A.反应①的试剂与条件为Cl2/光照
B.化合物E能发生银镜反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.Y的分子式为C11H13NCl
(3)写出反应④的化学方程式________________。
(4)芳香族化合物M是B的同分异构体,M含有二个六元环,则M可能的结构有_______________。
(5)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。试写出由C的一种同分异构体制备合成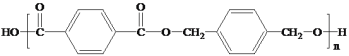 的线路图。___________
的线路图。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图可以从不同角度研究含氮物质的性质及其转化关系。图中甲~辛均含氮元素。回答下列问题:
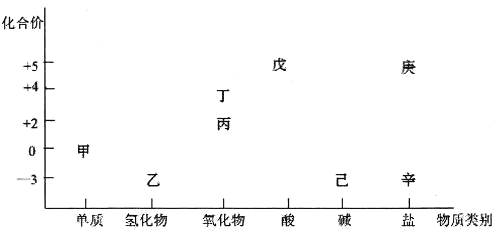
(1)下列给出的图中物质之间的转化可以一步实现的是__________。
A.甲→丁 B.乙→丁 C.丁→戊 D.戊→丙
(2)下列说法正确的是____________。
A.丙和丁在一定条件下都能生成戊,属于酸性氧化物
B.“甲→乙→丙→丁→戊”就是工业制戊的转化过程
C.己和辛在一定条件下都可与固体NaOH作用生成乙,其生成乙的原理相同
D.如果庚和辛为同种物质,则可由乙和戊反应制得
(3)氯碱工业生产中常用乙检查氯气管道是否泄漏,其现象为______________________。已知反应过程中还有甲生成,该反应的化学方程式为______________________________。
(4)已知铁与过量戊的溶液反应,其反应的化学方程式为:Fe+戊→丙+丁+庚+H2O(方程式未配平)。若产物中丙和丁的物质的量之比为1:3,则铁与戊的物质的量之比为_________。若检验庚中铁元素的价态,可选用的试剂为_________,反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com