
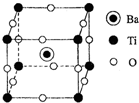
 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.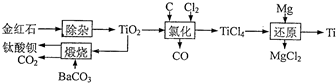
| 4+2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
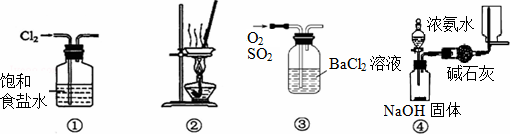
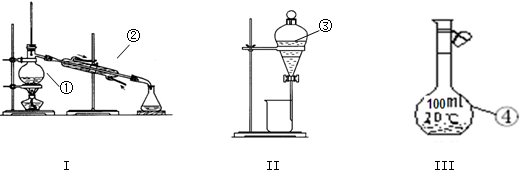
| A、用装置①除去Cl2中含有的少量HCl |
| B、用装置②从KCl溶液中获得KCl晶体 |
| C、用装置③除去O2中混有的一定量SO2 |
| D、用装置④在实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
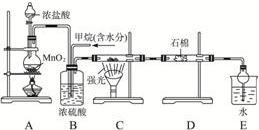
| V(Cl2) |
| V(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
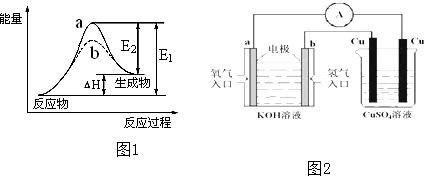
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 判断依据 | 结论(写结构简式) |
| 核磁共振氢谱有 个峰 | |
| 核磁共振氢谱有 个峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com