
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
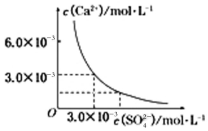
分析 (1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中C(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,再根据磷酸根浓度计算c(Ca2+);
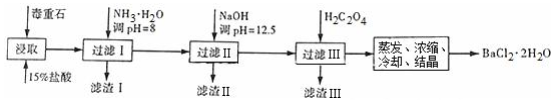
(2)制备BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2•2H2O,
①研磨将块状固体变成粉末状,可以增大反应物的接触面积,增大反应速率;
②根据流程图和表中数据分析加入NH3•H2O调节pH=8可除去Fe3+,加入NaOH调pH=12.5,可完全除去Mg2+,除去部分Ca2+,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入过量H2C2O4,易发生Ba2++H2C2O4═BaC2O4↓+2H+,产品的产量减少;
(3)通过图象分析得到该温度下硫酸钙饱和溶液中的沉淀溶解平衡为:CaSO4(s)?Ca2++SO42-;c(Ca2+)=c( SO42-)=3.0×10-3 mol/L;溶度积常数Ksp(CaSO4)=c(Ca2+)×c( SO42-)=9.0×10-6通过计算混合溶液中钙离子浓度和硫酸根离子浓度,乘积与Ksp比较来判断沉淀的生成与溶解.
解答 解:(1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中C(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为C2(PO43-)=$\frac{{K}_{SP}[M{g}_{3}(P{O}_{4})_{2}]}{C(M{g}^{2+})^{3}}$=$\frac{6.0×1{0}^{-29}}{(1{0}^{-5})^{3}}$=6.0×10-14,所以c(Ca2+)=$\root{3}{\frac{6.0×1{0}^{-26}}{6.0×1{0}^{-14}}}$=10-4,
故答案为:Mg3(PO4)2;10-4;
(2)①化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,
故答案为:增大接触面积从而使反应速率加快;
②根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,
故答案为:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少;
(3)由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c( SO42-)=3.0×10-3 mol/L,Ksp(CaSO4)=9.0×10-6.当向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol/L的Na2SO4溶液后,混合液中c(Ca2+)=$\frac{0.1L×3.0×1{0}^{-3}mol/L}{0.1L+0.4L}$=6.0×10-4 mol/L,c(SO42-)=$\frac{0.1L×3.0×1{0}^{-3}mol/L+0.4L×0.01mol/L}{0.1L+0.4L}$=8.6×10-3 mol/L,溶液中c(Ca2+)•c( SO42- )=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出,最终溶液中硫酸根离子浓度增大,
故选D.
点评 本题考查了沉淀溶解平衡的计算、实验室利用毒重石制备BaCl2•2H2O的设计方法,侧重考查影响反应速率的因素、实验基本操作、沉淀溶解平衡的应用等知识,实验步骤结合物质的性质分析是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 右边电极上生成物质的质量:①=② | |
| B. | 两级上产生气体的体积:①<② | |
| C. | 溶液的pH变化:①增大,②不变 | |
| D. | 电极反应式:①中阳极2H2O-4e-=4H++O2↑②中负极2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com