
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。

(1)写出下列物质的化学式:A:__________,D:___________,R:_____________。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式______________________________;
B和Q反应的离子方程式_________________________________________;
D与稀硝酸反应的离子方程式______________________________________________。
(3)检验溶液N中阴离子的方法、现象及离子方程式为_________________________________。
【答案】Na2O2 Fe3O4 Al 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O 取溶液于试管中滴加盐酸,先出现白色沉淀后溶解;AlO2-+H+ +H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O
【解析】
A为淡黄色固体,且A能与水反应故,即A为Na2O2,T、R为两种常见的用途很广的金属单质,即为Fe和Al,D是具有磁性黑色晶体,即D为Fe3O4,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,即H为Fe(OH)2,.M为Fe(OH)3,W为FeCl3,C为无色无味的气体,则C为O2,B为NaOH,R为Al,则T为Fe,Q为氧化铝,N为NaAlO2,E为FeCl2和FeCl3;
A为淡黄色固体,且A能与水反应故,即A为Na2O2,T、R为两种常见的用途很广的金属单质,即为Fe和Al,D是具有磁性黑色晶体,即D为Fe3O4,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,即H为Fe(OH)2,.M为Fe(OH)3,W为FeCl3,C为无色无味的气体,则C为O2,B为NaOH,R为Al,则T为Fe,Q为氧化铝,N为NaAlO2,E为FeCl2和FeCl3;
(1)根据上述分析,A为Na2O2,D为Fe3O4,R为Al;
(2)Fe(OH)2容易被氧气氧化,Fe(OH)2潮湿空气中发生的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;氧化铝为两性氧化物,能与NaOH发生Al2O3+2OH-=2AlO2-+H2O;D为Fe3O4,与稀硝酸发生氧化还原反应,离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)N为NaAlO2,阴离子为AlO2-,利用氢氧化铝为两性氢氧化物,因此检验AlO2-操作方法是取溶液于试管中滴加盐酸,先出现白色沉淀,继续滴加盐酸,沉淀溶解;AlO2-+H+ +H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O。


科目:高中化学 来源: 题型:
【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
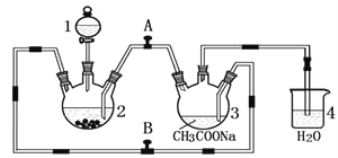
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的结构简式为:![]() ,它可以通过下列路线合成(分离方法和其他产物已经略去);已知-NH2显碱性,且易被氧化,同时可以和-COOH脱水缩合形成肽键(
,它可以通过下列路线合成(分离方法和其他产物已经略去);已知-NH2显碱性,且易被氧化,同时可以和-COOH脱水缩合形成肽键(![]() )。
)。
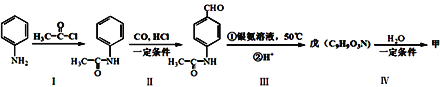
下列说法不正确的是
A. 甲可以发生取代反应、加成反应
B. 步骤I的反应方程式是: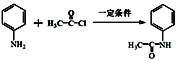
C. 戊分子中含有的官能团只有两种
D. 步骤I和IV在合成甲过程中的目的是保护氨基不被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学研究表明,姜黄素具有降血脂、抗肿瘤、消炎、抗氧化等作用。姜黄素的合成路线如下所示:

已知信息:
①1mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3mol、2mol、1mol。

请回答下列问题:
(1)C物质的名称是_____________;J物质的分子式为______________;E到G的反应类型为______________。
(2)B中官能团的名称为_____________________;E物质的结构简式为________________。
(3)D与银氨溶液反应,再酸化可生成E;请写出此氧化过程的化学方程式:_____________________________________。
(4)写出2mol K物质和1mol![]() 转换为姜黄素的化学反应方程式:_____________________________________。
转换为姜黄素的化学反应方程式:_____________________________________。
(5)K的同分异构体中符合下列信息:
①含有苯环; ②苯环上只有两个支链; ③遇FeCl3溶液变色; ④含有![]() 结构。
结构。
符合上述条件的K的同分异构体有_____________________种。
(6)有机物L( )是一种重要的有机化合物。参照上述合成路线,补全以甲苯、
)是一种重要的有机化合物。参照上述合成路线,补全以甲苯、![]() 为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学使人们的生活越来越美好,下列过程没有涉及化学反应的是
A. 用四氯化碳萃取碘水中的碘B. 用氯化铁溶液刻制印刷电路
C. 用漂白粉漂白纸张D. 用油脂和氢氧化钠溶液制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O![]() Cl2+H2↑+2OH—
Cl2+H2↑+2OH—
B. CuC12溶液中加入氨水:Cu2++2OH- Cu(OH)2↓
C. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2 2I2+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是( )
A.SiO2是良好的半导体材料
B.NaOH可用于治疗胃酸过多
C.Na2O2可用作潜水艇的供氧剂
D.明矾可用作自来水的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com