
����Ŀ�������ͣ�C3H8O3��ת��Ϊ�߸�ֵ��Ʒ�ǵ�ǰ�ȵ��о���������ͺ�ˮ�������������������ִ��������Ƶ���������Ӧ��Ҫ�������£�

��1������˵����ȷ����______������ĸ��ţ���
a.���ĵ����ĸ��ͣ���ӦI�IJ��������
b.���ĵ����ĸ��ͣ���ӦII�ķ���������
c.��������õ���ӦIII��H3=-237.5 kJ/mol��
d.�����ϣ�ͨ�����ظ��͡�ˮ������������������������ʵ������������Ӧ�����ʱ�ԼΪ0���������˿��й����߶����Ⱥͷ��ȷ�Ӧ������Ӧ��
��2���о���Ա�����������飬ʵ�������н���ӦIII�趨�ڽϸ��¶ȣ�600~700��C�����У�ѡ����¶ȷ�Χ��ԭ���У��������Ժ�ѡ���Ըߡ�____________��
��3���о���Ա���֣���ӦI�ĸ�����ܶ࣬��Ҫ���У�CH4��C2H4��CO��CO2��CH3CHO��CH3COOH�ȣ�Ϊ��������������IJ��ʣ���ȡ����������ʩ��
����Ҫ���Ʋ�������ĸ���Ӧ����ԭ�������ʽǶȷ�����ԭ��__________________��
����CaO������ǿ���⡣��ͼ1��ʾ������ͼ���CaO��ԭ��____________________��
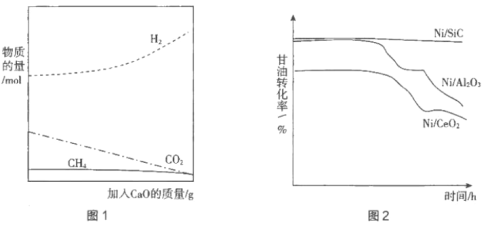
��4���Ʊ���Ч�Ĵ������������ⷽ���ܴ��ģӦ���ڹ�ҵ����Ҫ���ء�ͨ����Ni��ɢ�ڸ߱ȱ�������壨SiC��Al2O3��CeO2��������ߴ�Ч�ʡ��ֱ������ִ�������ʵ�飬����ͨ��ԭ��������һ��ʱ���ڶ��ȡ�������Ƹ���ת������ʱ��Ĺ�ϵ��ͼ2��ʾ��
�ٽ��ͼ2����Ni/SiC�������е��ŵ���____________________��
���о�������ɴ�Ч����ʱ���½�����Ҫԭ���Ǹ���Ӧ�����Ĵ���̼�ۣ���̼������������ͨ���������ġ���ѭ�����õ������磨La2O3������Ч���ٻ�̼���䷴Ӧ��������������
��һ��Ϊ��La2O3+CO2 ![]() La2O2CO3
La2O2CO3
�ڶ���Ϊ��______________________________��д����ѧ��Ӧ����ʽ����
���𰸡�abcd �����ʸߣ���ѧ��Ӧ���ʿ� CH4����Ԫ�ص�����������ߣ����Ʋ�������ĸ���Ӧ��������������Ӧ��ȣ��������������ԭ�ӵ������� ����CaO�ɽ��Ͷ�����̼��Ũ�ȣ��ٽ���ӦIƽ�������ƶ�����������IJ��� ��Ч�ʸߣ��ȶ��Ժ� La2O2CO3+C= La2O3+2CO
��������
��1��ץס������Ϣ��˹���ɷ������ɽ��
��2����Ҫ���¶ȶԷ�Ӧ���ʺͻ�ѧƽ����ƶ���Ӱ��ĽǶȽ��з������
��3���������еĸ������У�CH4����Ԫ�ص�����������ߣ����Ʋ�������ĸ���Ӧ��������������Ӧ��ȣ��������������ԭ�ӵ������ʣ��ݴ˷����ɵý��ۣ��ڸ���ͼ1��֪������CaO�ɽ��Ͷ�����̼��Ũ�ȣ��ٽ���ӦIƽ�������ƶ�����������IJ��ʣ��ݴ˷����ɵý�����
��4������ͼ2��Ϣ��֪��Ni/SiC�����Ĵ�Ч�ʲ�����ʱ����ӳ������ͣ��������ִ��������ִ�Ч�ʽ��͵������ɴ˷�����𣻢��������Ϣ��֪���������������̿�����У�C+CO2![]() 2CO���������ã���ڶ�����ӦΪ��̿��La2O2CO3��Ӧ����La2O3��CO���ɴ˿ɵý�����
2CO���������ã���ڶ�����ӦΪ��̿��La2O2CO3��Ӧ����La2O3��CO���ɴ˿ɵý�����
��1��a.�ɷ�ӦI����ӦII����ӦIII�Աȿ�֪�����ĵ����ĸ��ͣ���ӦI�IJ�������ߣ���a��ȷ��
b. �ɷ�ӦI����ӦII����ӦIII�Աȿ�֪��������1mol����ʱ����Ӧ��ӦII�зų���������࣬��b��ȷ��
c.�ɸ�˹���ɿ�֪��H3=![]() H1+
H1+![]() H2=��+128kJ/mol����2+��-603 kJ/mol����2=-237.5 kJ/mol����c��ȷ��
H2=��+128kJ/mol����2+��-603 kJ/mol����2=-237.5 kJ/mol����c��ȷ��
d.��ӦIΪ���ȷ�Ӧ����ӦIIΪ���ȷ�Ӧ�����ڷ�Ӧ�����п�ͨ�����ظ��͡�ˮ������������������������ʵ���ʱ�ԼΪ0����d��ȷ��
�ʴ�Ϊ��abcd��
��2����ӦIΪ���ȷ�Ӧ���ڽϸ��¶��������ڷ�ӦI�Ľ��У��Ӷ���߲����ʣ�ͬʱ�����¶ȿɼӿ췴Ӧ���ʣ��ʴ�Ϊ�������ʸߣ���ѧ��Ӧ���ʿ죻
��3���������еĸ������У�CH4����Ԫ�ص�����������ߣ����Ʋ�������ĸ���Ӧ��������������Ӧ��ȣ��������������ԭ�ӵ������ʣ��ʴ�Ϊ��CH4����Ԫ�ص�����������ߣ����Ʋ�������ĸ���Ӧ��������������Ӧ��ȣ��������������ԭ�ӵ������ʣ�
�ڸ���ͼ1��֪������CaO�ɽ��Ͷ�����̼��Ũ�ȣ��ٽ���ӦIƽ�������ƶ�����������IJ��ʣ��ʴ�Ϊ������CaO�ɽ��Ͷ�����̼��Ũ�ȣ��ٽ���ӦIƽ�������ƶ�����������IJ��ʣ�
��4������ͼ2��Ϣ��֪��Ni/SiC�������д�Ч�ʸߣ��ȶ��Ժõ��ص㣬�ʴ�Ϊ����Ч�ʸߣ��ȶ��Ժã�
���������Ϣ��֪���������������̿�����У�C+CO2![]() 2CO���������ã���ڶ�����ӦΪ��̿��La2O2CO3��Ӧ����La2O3����Ӧ����ʽΪ��La2O2CO3+C= La2O3+2CO���ʴ�Ϊ��La2O2CO3+C= La2O3+2CO��
2CO���������ã���ڶ�����ӦΪ��̿��La2O2CO3��Ӧ����La2O3����Ӧ����ʽΪ��La2O2CO3+C= La2O3+2CO���ʴ�Ϊ��La2O2CO3+C= La2O3+2CO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת������һ��ʵ�ֵ��ǣ� ��
A. N2��NO2 B. HNO3��O2 C. SO2��H2SO4 D. H2SO4��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ����������ʽ����ʾ,��CH3CH=CHCH3�ɼ�дΪ![]() ���л���X�ļ���ʽΪ
���л���X�ļ���ʽΪ![]() ������˵������ȷ���ǣ� ��
������˵������ȷ���ǣ� ��
A. X�Ļ�ѧʽΪC8H8
B. �л���Y��X��ͬ���칹�壬�����ڷ���������Y�Ľṹ��ʽΪ![]()
C. X��ʹ���Ը��������Һ��ɫ
D. X��������H2��һ�������·�Ӧ�����ɱ�����Z, Z��һ�ȴ�����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A����ʹ����KMnO4��Һ��ɫ����̼��Ϊ92.3%��0.1mol A��ȫȼ��ʱ����13.44L������̼(��״��)��
��1��A�Ľṹ��ʽΪ_________��
��2��������������д���йط�Ӧ�Ļ�ѧ����ʽ��ָ����Ӧ���ͣ�
��A��Ũ�����Ũ����Ļ��Һ��Ӧ����B��__________��___________��Ӧ��
���ڴ���������A��H2��Ӧ����C��_______________��__________��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�2.24L SO3�к��е���ԭ����ĿΪ0.3NA
B. 18gH218O��2H2O�Ļ�����У�����������Ϊ10NA
C. һ�������£�2.3g�Ľ�������ȫ��������Ӧʱ����3.6g����ʱʧȥ�ĵ�����Ϊ0.1NA
D. ���ʵ���Ũ��Ϊ0.1molL��1��MgCl2��Һ�У�����Cl������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ�����ᴿ��˵������ȷ����
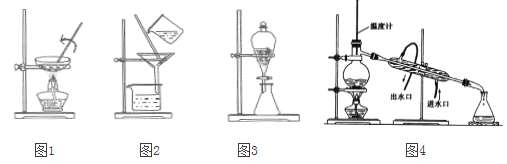
A. ͼ1����FeCl2��Һ����ȡFeCl2����B. ͼ2������NaCl��Һ��MgSO4
C. ͼ3����CCl4��ȡ������ˮ�еõ�����D. ͼ4��������ķ�������ƾ���ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǻ�ˮ�к�����ḻ��Ԫ�أ��ȵĵ��ʼ��仯���������ɡ���������Ӧ�ù㷺��
��1������ˮ������Һ�Ƚ���ɱ����������������ˮ�����Ŀ��淴ӦΪ______________�������ӷ���ʽ��ʾ����
��2����Һ��������������л��ȴ��Σ�����彡��������ʹ�ö������ȣ�ClO2������Һ�ȡ���ҵ���Ի�����FeS2���������ƣ�NaClO3����������Һ����Ʊ������������塣��֪�������е���Ԫ�أ�-1�ۣ�����������SO42-��д���Ʊ��������ȵ����ӷ���ʽ_____________________________________��
��3������Ư�۹�������Ҫ�豸���Ȼ����������ϵ��·�Ϊ�IJ㣬��ͼΪ��������ʾ��ͼ��
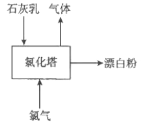
����Ư�۷�Ӧ�Ļ�ѧ����ʽΪ_____________________��ʵ�������У���ʯ���飨����3%-6%ˮ�ֵ���ʯ�ң��������������£�������������ײ�ͨ�롣�������ϵ�Ŀ����_____________________________��
��4����Ī�������Բⶨ��Һ��Cl-�ĺ�����Ī������һ�ֳ����ζ������ñ�AgNO3��Һ�ζ�����Һ����K2CrO4Ϊָʾ�����ζ��յ����������Һ�г���ש��ɫ������Ag2CrO4������֪ƽ��Cr2O72-+H2O![]() 2CrO42-+2H+���õζ�������Ҫ����pH��Χ��6.5~10.5����pHС��6.5��ʹ�ⶨ���ƫ�ߡ����ƽ���ƶ�ԭ������ƫ�ߵ�ԭ��:_______________________________ ��
2CrO42-+2H+���õζ�������Ҫ����pH��Χ��6.5~10.5����pHС��6.5��ʹ�ⶨ���ƫ�ߡ����ƽ���ƶ�ԭ������ƫ�ߵ�ԭ��:_______________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ѧϰ�������ε����ʺ���̽��FeSO4��Һ�ֱ���Na2CO3��Һ��NaHCO3��Һ�ķ�Ӧ����֪��Fe��OH��2��FeCO3��Ϊ��ɫ������������Fe��HCO3��2��ʵ������������¼���£�
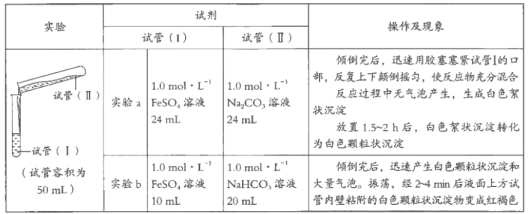
��1����ͬѧ��Ϊʵ��a�а�ɫ����״������FeCO3��д���÷�Ӧ�����ӷ���ʽ��_________________________����Ϊ��֤ʵ�Լ��Ĺ۵㣬����ʵ�飺ȡ������ɫ����״����������__________�����ֲ����������ݡ�
��2����ͬѧ�Ʋ�ʵ��a�İ�ɫ����״�����л����ܺ���Fe��OH��2������ʵ��a��������Һ�������Ϊ15mL���ٽ���ʵ�飬֤ʵ�������Ʋ⡣��֤��Fe��OH��2���ڵ�ʵ��������___________________________��
��3��ʵ��b�а�ɫ����״������Ҫ�ɷ�ҲΪFeCO3��д������FeCO3�����ӷ���ʽ��_____________________________��
��4��ʵ��b��Һ���Ϸ��Թ��ڱ�ճ���İ�ɫ����״�������Ϊ���ɫ����Ҫԭ���dz�ʪ��FeCO3������������д���÷�Ӧ�Ļ�ѧ����ʽ��_________________��
��5����ͬѧ��˼��ʵ��a�к���Fe��OH��2��ʵ��b�м���������Fe��OH��2���Աȷ������ֲ����ԭ����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����ͨ�������ַ�����
���ù��������������Ȼ�粒��ȣ�
���ڳ������ù�������������Ũ��ˮ��Ӧ��
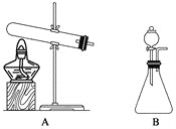
(1)�������ȡװ��ͼ�У�������Ӧѡ��װ��__________(����A������B������ͬ)��������Ӧѡ��װ��__________��
(2)�����Ȼ�����������ƻ������ȡ�����ķ�Ӧ����ʽ��________________��
(3)����ȡ�����Ҫ���ﰱ����Ӧѡ�õĸ������________________������ĸ����
A��Ũ���ᡡ����B����ʯ�ҡ�����C������������
(4)���鼯��ƿ���Ƿ��ռ��������ķ�����__________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com