
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2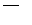 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2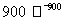 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗
 B.该过程实现了太阳能向化学能的转化
B.该过程实现了太阳能向化学能的转化
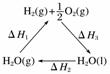
C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO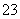 +2H2O
+2H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T
C.T和U D.R和T
E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:________________________________________________________________________,
如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第______个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是__________,其中________元素的第一电离能异常高的原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2 mol SO2、1 mol O2,达到平衡时放出热量为Q1 kJ,在同样条件下,向该容器中通入2 mol SO3,达到平衡时,吸收热量为Q2 kJ,则Q1和Q2的关系为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.-488.3 kJ·mol-1 B.488.3 kJ·mol-1
C.-191 kJ·mol-1 D.191 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)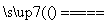 CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+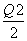 ) kJ
) kJ
D.M(g)+N(g)R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1②X(g)—→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是( )
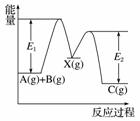
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是________。
(2)工业上生产粗硅的反应有:SiO2+2C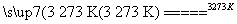 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C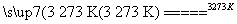 SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________。
(3)工业上可以通过如图所示的流程制取纯硅:
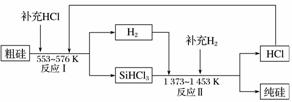
①若反应Ⅰ为Si(粗)+3HCl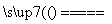 SiHCl3+H2,则反应Ⅱ的化学方程式为________________________。
SiHCl3+H2,则反应Ⅱ的化学方程式为________________________。
②整个制备过程中必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:__________________。
③假设每一轮次制备1 mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com