
【题目】研究高效催化剂是解决汽车尾气中的 NO 和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃时,在分别装有催化剂 A 和 B 的两个容积为 2 L 的刚性密闭容器中,各充入物质的量均为nmol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表:
时间/min | 0 | 10 | 20 | 30 | ∞ |
A容器内压强/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器内压强/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判断催化剂 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡转化率为 __________。400℃时,用压强表示的平衡常数Kp__________(kPa)-1 (保留两位小数)。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是 __________。
(3)为研究气缸中NO的生成, 在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应 N2(g)+ O2(g)2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是_________(填序号)。
A.2v正(O2)= v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=l D.容器内温度不变
②为减小平衡混合气中 NO 的体积分数, 可采取的措施是 ___________。
(4)对于气缸中N的生成,化学家提出了如下反应历程:
第一步 O22O 慢反应
第二步 O+N2NO+N 较快平衡
第三步 N+O2NO+O 快速平衡
下列说法错误的是_______(填标号)。
A.第一步反应不从N2分解开始,是因为N2比O2稳定
B.N、O 原子均为该反应的催化剂
C.三步反应中第一步反应活化能最大
D.三步反应的速率都随温度升高而增大
【答案】-794.5 A 80% 4.27 排气管是敝口容器,管中进行的反应为非平衡态,该非平衡条件下,反应速率越快,相同时间内污染物转化率就越高 AD 降低温度 B
【解析】
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
②C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
③N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
根据盖斯定律,2×①-(2×②+③)得2NO(g)+ 2CO(g)=N2(g)+ 2CO2( g) △H=-393.5 kJ/mol×2-(-110.5 kJ/mol)×2 -180.0 kJ/mol=-794.5 kJ/mol,故答案为:-794.5;
(2)①根据表中数据分析A容器中反应先达到平衡,则催化剂A的效果更好,故答案为:A;
②设平衡时反应的CO的物质的量为x,则
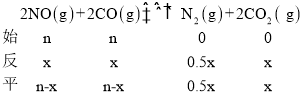
则![]() ,解得x=
,解得x=![]() ,CO的平衡转化率为
,CO的平衡转化率为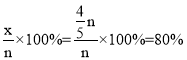 ;平衡时NO、CO、N2、CO2的物质的量分别为
;平衡时NO、CO、N2、CO2的物质的量分别为![]() 、
、![]() 、
、![]() 、
、![]() ,则各物质的分压分别为
,则各物质的分压分别为![]() 、
、![]() 、
、![]() 、
、![]() ,
,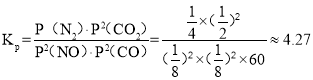 (kPa)-1,故答案为:80%;4.27;
(kPa)-1,故答案为:80%;4.27;
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是排气管是敝口容器,管中进行的反应为非平衡态,该非平衡条件下,反应速率越快,相同时间内污染物转化率就越高,故答案为:排气管是敝口容器,管中进行的反应为非平衡态,该非平衡条件下,反应速率越快,相同时间内污染物转化率就越高;
(3)①A. 2v正(O2)= v逆(NO)=2v逆(O2),正反应速率等于逆反应速率,则说明反应达到平衡状态,故A选;
B. 混合气体的平均相对分子质量始终保持不变,所以B不选;
C. c(N2):c(O2)=l不能说明反应物、生成物的浓度保持不变,故C不选;
D 该反应伴随着能量不变,该容器内温度不变,说明转化率不变,能说明反应达到平衡状态,故D
②该反应为吸热反应,降低温度平衡逆反应方向移动,NO的体积分数降低,故答案为:降低温度;
(4)A. 根据题给反应机理分析,N2比O2稳定,所以第一步反应不从N2分解开始,故A正确;
B. 根据反应历程分析,O 原子为该反应的催化剂,故B错误;
C. 三步反应中第一步反应速率最慢,说明活化能最大,故C正确;
D. 温度升高,增大活化分子百分数,所以三步反应的速率都随温度升高而增大,故D正确;故答案为:B。


科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:
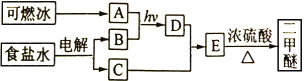
(1)B为黄绿色气体,其化学名称为____________。
(2)由A和B生成D的化学方程式为__________________。
(3)E的结构简式为____________。
(4)由E生成二甲醚的反应类型为______________________。
(5)二甲醚的同分异构体的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1mL 0.1mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1mol·L![]() ):
):
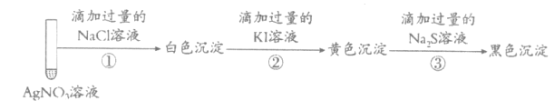
下列说法不正确的是
A.实验①白色沉淀是难溶的AgCl
B.由实验②说明AgI比AgCl更难溶
C.若按①③②顺序实验,看不到黑色沉淀
D.若按②①③顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20.00mL 0.100 mol·L![]() HX中滴加0.100 mol·L
HX中滴加0.100 mol·L![]() NaOH过程中,pH变化如下图所示。
NaOH过程中,pH变化如下图所示。
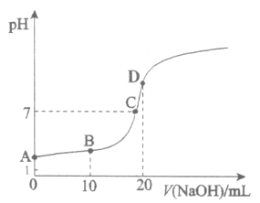
(1)写出HX的电离方程式:__________。
(2)下列有关B点溶液的说法正确的是__________(填字母序号)。
a. 溶质为:HX、NaX
b. 微粒浓度满足:c(Na+)+c(H+)=c(X-)+c(OH-)
c. 微粒浓度满足:c(Na+)=c(HX)+c(X-)
d. 微粒浓度满足:c(X-)>c(Na+)>c(H+)>c(OH-)
(3)A、C两点水的电离程度:A__________C(填“>”、“<”或“=”)。
(4)C点对应离子浓度由大到小的顺序为__________。
(5)用离子方程式解释D点溶液pH>7的原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
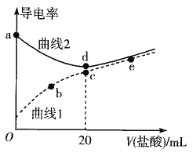
下列说法正确的是
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
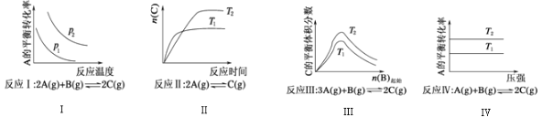
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
C.反应Ⅱ:△H>0,T1>T2
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com