
【题目】下列说法正确的是![]()
A.100mL、![]() 的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB弱
的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB弱
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.在![]() 溶液中由于铵根的水解促进了水的电离,所以水的电离程度增大
溶液中由于铵根的水解促进了水的电离,所以水的电离程度增大
D.在一密闭容器中发生![]() 反应,增大压强,平衡会正向移动,
反应,增大压强,平衡会正向移动, 的值增大
的值增大
科目:高中化学 来源: 题型:
【题目】下列有机反应中,属于加成反应的是
A.CH2=CH2+Br2![]()
![]()
B.![]() + HNO3
+ HNO3![]()
![]() +H2O
+H2O
C.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述中错误的是( )
A.1mol铜与足量硫反应时转移电子数目为NA
B.31g白磷(分子式为P4)中含有P-P共价键数目为1.5NA
C.1molNa与一定量O2完全反应,生成Na2O和Na2O2混合物含有离子总数1.5NA
D.标准状况下,1mol氦气含有的质子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是![]()
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀.
先形成沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。

下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色澄清的溶液:Na+、NH![]() 、S2-、ClO-
、S2-、ClO-
B.能使石蕊变红的溶液:Fe2+、Na+、NO![]() 、SO
、SO![]()
C.水电离的c(H+)=1×10-13mol·L-1的溶液中:Ba2+、K+、HCO![]() 、S2-
、S2-
D.![]() =10-12的溶液中:Na+、NO
=10-12的溶液中:Na+、NO![]() 、AlO
、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
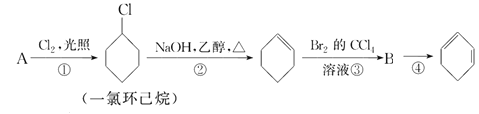
(1)A的结构简式是________,名称是________。
(2)①的反应类型是________,③的反应类型是________。
(3)反应②的化学方程式是_____________________________。
(4)反应③的化学方程式是_____________________________。
(5)反应④的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:
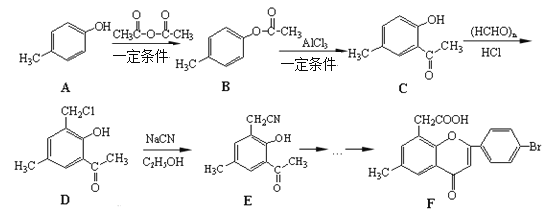
已知:RCN在酸性条件下发生水解反应: RCN ![]() RCOOH
RCOOH
(1)上述路线中A转化为B的反应为取代反应,写出该反应的化学方程式________。
(2)F分子中有3种含氧官能团,名称分别为醚键、_____________和______________。
(3)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为_________________________。一定条件
(4)写出一种符合下列条件的D.的同分异构体的结构简式________________。
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物含有酚羟基,另一种水解产物含有醛基。
(5)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。______________
)是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。______________
合成路线流程图请参考如下形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三价铁配合物的化学式可表示为Ka[Feb(C2O4)c]·xH2O,为测定其组成,进行如下实验:
步骤1:称取1.9640g该配合物晶体,配制成250.00mL溶液。
步骤2:取所配溶液25.00mL于锥形瓶中,加入1mol·L-1硫酸5.0mL,加热到70~85℃,用0.0100mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液48.00mL。
步骤3:向反应后的溶液中加入一定量锌粉。加热至黄色恰好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤4:继续用0.0100mol·L-1KMnO4溶液滴定步骤3所得溶液至终点,消耗KMnO4溶液8.00mL。
(1)步骤2中,KMnO4将C2O![]() 氧化为CO2,该滴定反应的离子方程式为___。
氧化为CO2,该滴定反应的离子方程式为___。
(2)步骤3中黄色消失的原因是___(用离子方程式表示)。
(3)配制配合物溶液的过程中,若定容时俯视容量瓶的刻度线,则最终所得晶体组成中水的含量___(填“偏大”“偏小”或“无影响”)。
(4)通过计算确定该三价铁配合物的化学式___(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com