
����pH��2�Ĵ�����Һ��pH��2�������ң���������в����ش����⣺
(1)ȡ10 mL�ļ���Һ������������ˮ������ĵ���ƽ��________�ƶ�(����������ҡ�����)����ȡ10 mL�ļ���Һ������������ˮ�����ƹ���(����������ǰ����Һ������ֲ���)���������ܽ����Һ�� 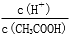 �ı�ֵ��____________(���������С������ȷ����)��
�ı�ֵ��____________(���������С������ȷ����)��
(2)��ͬ�����£�ȡ������ļס�������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵΪ��pH(��)___ _______pH(��)(����ڡ�����С�ڡ����ڡ�����ͬ)��
(3)��ȡ25 mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к���pH��7�������ĵ�NaOH��Һ�������С��ϵΪ��V(��)___________V(��)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƶ���ˮ�ڹ�������ɫ��dz | |
| B�� | H2��I2��HIƽ��������Сѹǿ�������������ʹ��ɫ��dz | |
| C�� | ����ˮƿ�ǣ�������ð�� | |
| D�� | �ںϳɰ��ķ�Ӧ�У���ѹ�����ڰ��ĺϳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �غ�ˮ | B�� | �����ƺ�ˮ | C�� | �����ƺ�ˮ | D�� | �������ƺ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ������ | ���Ӱ뾶 | �۵� | ���� |
| P��S | O2-��Na+ | CaO��MgO | HClO4��H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��V1ml1.0mol��L��1HCl��Һ��V2mlδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1+ V2=50ml)������������ȷ����( )
V2=50ml)������������ȷ����( )
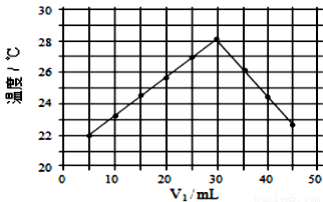
A. ����ʵ��ʱ�����¶�Ϊ22��
B. ��ʵ��������ܿ�ת��Ϊ��ѧ��
C. NaOH��Һ��Ũ��ԼΪ1.5mol��L��1
D. ��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������Ȼ�ѧ����ʽ�ó��Ľ��۲���ȷ����( )
A����C(s��ʯī)�TC(s�����ʯ) ��H��0��֪�����ʯ��ʯī�ȶ�
B��CO(g)ȼ������283.0kJ•mol��1����2CO2(g)�T2CO(g)+O2(g)��H=+566.0kJ•mol��1
C��CH4(g)+2O2(g)�TCO2+2H2O(I)��H��0���÷�Ӧ�Ļ�ѧ�ܿ���ת��Ϊ����
D����֪C(s)+O2(g)�TCO2(g)��H1��C(s)+ O2(g)�TCO(g)��H2�����H1����H2
O2(g)�TCO(g)��H2�����H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶����¿�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��4 mol A�����4 mol B�����Ϸ���2 L�ĺ����ܱ������У���һ�������·�����Ӧ��2A��g��+2B��g��  C��g��+2D��g������5min�ﵽƽ�⣬ ���ѹǿ��С��10%������˵������ȷ����
C��g��+2D��g������5min�ﵽƽ�⣬ ���ѹǿ��С��10%������˵������ȷ����
A��ƽ����ϵ��C���������Ϊ1/9
B��ƽ��ʱA��Ũ��Ϊ2.4mol/L
C��D��ƽ������Ϊ0.32mol/��L��min��
D��B��ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
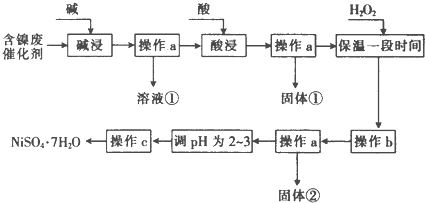
| ������ | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Al��OH��3 | 3.8 | 5.2 |
| Fe��OH��3 | 2.7 | 3.2 |
| Fe��OH��2 | 7.6 | 9.7 |
| Ni��OH��2 | 7.1 | 9.2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com