
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 水电离出来的c(H+)=1.0×10-12mol/L的溶液中,Al3+不可能大量存在 | |
| C. | 0.1mol/L的氨水中滴加稀盐酸至过量,可能有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
分析 A.CH3COOH溶液加水稀释,c(H+)减小,水的离子积不变,则c(OH-)增大;
B.水电离出来的c(H+)=1.0×10-12mol/L的溶液中存在大量氢离子或氢氧根离子,铝离子与氢离子反应;
C.当盐酸稍过量时,溶液显示酸性,则满足:c(Cl-)>c(NH4+)、c(NH4+)>c(H+)、c(H+)>c(OH-);
D.醋酸为弱酸,反应后氢离子浓度不可能大于钾离子浓度.
解答 解:A.CH3COOH溶液加水稀释,c(H+)减小,由于温度不变,水的离子积不变,根据Kw=c(H+)×c(OH-)可知c(OH-)增大,故A错误;
B.水电离出来的c(H+)=1.0×10-12mol/L的溶液为酸性或碱性溶液,Al3+不与氢离子反应,在酸性溶液中能够大量共存,故B错误;
C.0.1mol/L的氨水中滴加稀盐酸至过量,溶液呈酸性,可以满足:c(Cl-)>c(NH4+)、c(NH4+)>c(H+)、c(H+)>c(OH-),此时溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C正确;
D.在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,由于醋酸为弱酸,则反应后醋酸过量,但反应后溶液中一定满足c(H+)<c(K+),正确的离子浓度大小为:c(CH3COO-)>c(K+)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确弱电解质的电离、盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒等知识在判断离子浓度大小中的应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
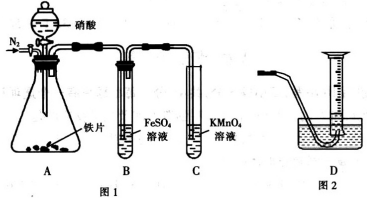 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.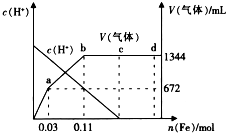
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- Cl- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应从产物结果可以得出还原性顺序:Fe2+>Br- | |
| C. | 第③组反应中生成1mol Cl2,转移电子数为2NA | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、铜 | B. | 稀硫酸、二氧化硫 | C. | 液态的醋酸、液氨 | D. | 熔融的KNO3、硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com