
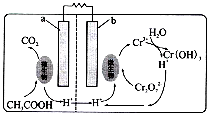
| A. | b极为负极 | |
| B. | a极反应式:CH3COOH+2H2O-8e-=2CO2+8H+ | |
| C. | 每处理1mol Cr2O72-生成CO2(标准状况下)3.36 L | |
| D. | 每生成lmol Cr(OH)3,右池n(H+)减少2 mol |
分析 A、b极Cr2O72-中铬由+7变成+3价,得电子发生还原反应;
B、a极为负极乙酸发生氧化反应生成二氧化碳;
C、根据得失电子守恒,每处理1mol Cr2O72-,转移6mol的电子,所以生成二氧化碳的物质的量为:$\frac{6×2}{8}$=1.5mol;
D、正极的电极反应式为:Cr2O72-+14H++6e-=2Cr3++7H2O,2Cr3++6H2O=2Cr(OH)3+6H+;
解答 解:A、b极Cr2O72-中铬由+7变成+3价,得电子发生还原反应,所以b极为正极,故A错误;
B、a极为负极乙酸发生氧化反应生成二氧化碳,电极反应式为:CH3COOH+2H2O-8e-=2CO2+8H+,故B正确;
C、根据得失电子守恒,每处理1mol Cr2O72-,转移6mol的电子,所以生成二氧化碳的物质的量为:$\frac{6×2}{8}$=1.5mol,标况下的体积为:1.5×22.4=33.6L,故C错误;
D、正极的电极反应式为:Cr2O72-+14H++6e-=2Cr3++7H2O,2Cr3++6H2O=2Cr(OH)3+6H+,生成2mol Cr(OH)3,右池n(H+)减少8 mol,所以每生成lmol Cr(OH)3,右池n(H+)减少4 mol,故D错误;
故选B.
点评 本题主要考查的知识点是原电池的工作原理,利用化合价的变化判断氧化剂与还原剂,依据得失电子守恒计算生成物.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
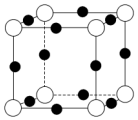 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: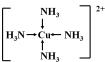 (用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
(用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
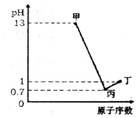 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验用品(省略夹持装置) | 相应实验 |
| A | 蒸发皿、玻璃棒、泥三角、三脚架 | 从食盐水中获得NaCl晶体 |
| B | 烧杯、玻璃棒、漏斗、滤纸 | 除去氢氧化铝胶体中的泥沙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用胆矾配制100mL0.1mol/L的硫酸铜溶液 |
| D | 蒸馏烧瓶、温度计、冷凝管、石棉网、牛角管、锥形瓶、酒精灯 | 用四氯化碳萃取溴水中的溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学应用 | 判断及解释 |
| A | 燃烧法可以鉴别羊毛和棉线 | 对.羊毛的主要成分是蛋白质,燃烧有烧焦羽毛气味. |
| B | 高锰酸钾可用于水果保鲜 | 错.因为高锰酸钾会氧化水果中的有机物 |
| C | SiO2可用于制备光导纤维 | 对.因为SiO2有导电性 |
| D | 误食重金属盐引起人体中毒均可以喝大量食盐水解毒 | 对.因为食盐水有解毒功能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 硫酸铜溶液的浓缩结晶 | 坩埚、玻璃棒、烧杯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属强弱 | 试管、胶头滴管 |
| C | 用8.0mol•L-1的盐酸配制250mL 1.5mol•L-1 的盐酸 | 250mL容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com