
| A. | 升高温度 | B. | 使用催化剂 | C. | 降低温度 | D. | 缩小容器体积 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)为置换反应 | B. | (2)为化合反应 | ||
| C. | 只有(1)(3)为氧化还原反应 | D. | (1)(2)(3)均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| B. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 实验室如果没有四氯化碳,可以用酒精代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O2和O3的混合气体中含有的原子数为NA | |
| B. | 在1L0.1 mol/L碳酸钠溶液中,CO32-总数为0.1 NA | |
| C. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| D. | 标准状况下,22.4L Cl2完全发生氧化还原反应一定转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
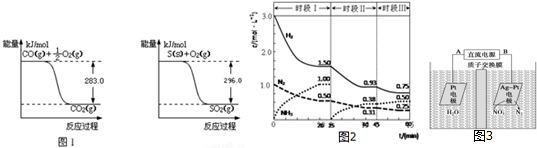
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 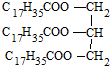 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 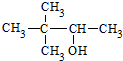 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com