
 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.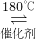 2N2(g)+3H2O(g)△H<0.
2N2(g)+3H2O(g)△H<0.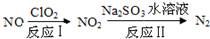
 得:CH4(g)+2N02(g)=N2(g)+C02(g)+2H20(g)△H=
得:CH4(g)+2N02(g)=N2(g)+C02(g)+2H20(g)△H= =-867KJ/mol,
=-867KJ/mol,

 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:阅读理解
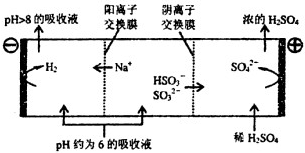
| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 催化剂 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
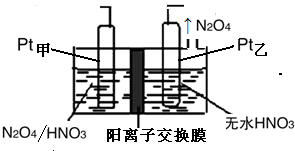 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.| 180℃ | 催化剂 |
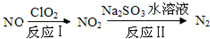
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
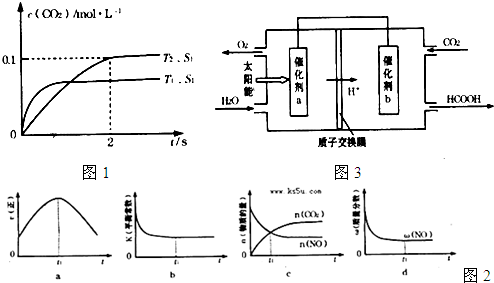
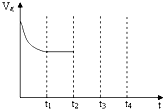 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com