
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
分析 A、铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B、氢氧化铝不能溶于过量的氨水;
C、不满足质量守恒;
D、FeCl2溶液跟Cl2反应生成FeCl3.
解答 解:A、铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式都是Al+2OH-+2H2O═2AlO2-+3H2↑,故A错误;
B、氢氧化铝不能溶于过量的氨水,故AlCl3溶液中加入足量的氨水生成的是Al(OH)3沉淀,且一水合氨不能拆:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C、Na2O2固体与水反应生成氢氧化钠和氧气,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D、FeCl2溶液跟Cl2反应生成FeCl3,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D正确.
故选D.
点评 本题考查了离子方程式的书写,应注意的是离子方程式要满足电荷守恒和质量守恒,难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:实验题
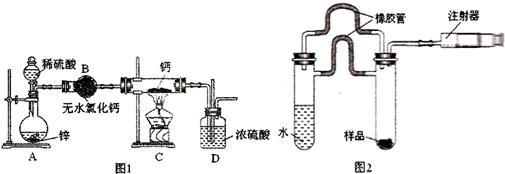
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
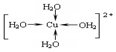 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
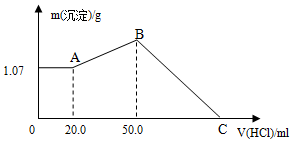 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
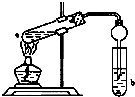 如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com