
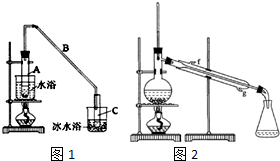
 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.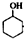 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
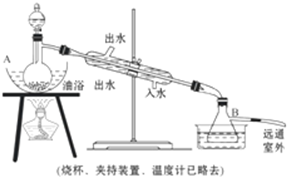
分析 (1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化;
③根据 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O分析浓H2SO4在反应中的作用;
+H2O分析浓H2SO4在反应中的作用;
(2)①环己烯不溶于氯化钠溶液,且密度比水小;
②为了使冷凝的效果更好,冷却水从冷凝管的下口进入,上口出;生石灰能与水反应生成氢氧化钙;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点,据此可判断产品的纯度.
解答 解:(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,
故答案为:防止暴沸;冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化,故答案为:进一步冷却,防止环己烯挥发;
③根据 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O,则浓H2SO4在反应中的作用催化剂、脱水剂,故答案为:催化剂、脱水剂;
+H2O,则浓H2SO4在反应中的作用催化剂、脱水剂,故答案为:催化剂、脱水剂;
(2)①环己烯是烃类,不溶于氯化钠溶液,且密度比水小,振荡、静置、分层后环己烯在上层,故答案为:上;
②为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;
故答案为:g;除去了残留的水;
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,另外根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度,
故答案为:bc.
点评 本题考查了以环己醇制备环己烯的实验方法,综合考查了物质的分离方法,冷凝,产量的分析等,难度适中,考查学生解决实际问题的能力.


科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
中国历史悠久,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是( )
A.闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺
B.四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,80年代国家强制给食用的氯化钠食盐中加入碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
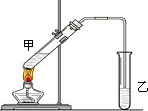 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: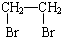 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
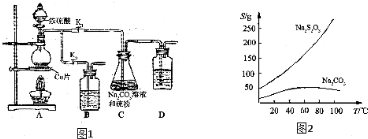
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
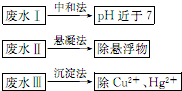 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com