
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必须首先进行的一步操作是__。
(4)A中加入的试剂可能是__,作用是__;B中加入的试剂可能是__,作用是__;E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:
C中:__,
D中:__。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?__(填“能”或“不能”),原因是_。
【答案】Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O 当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 检验装置的气密性 品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色变成红色 白色粉末变成蓝色 不能 因为混合气体中含H2O会干扰H2的检验
ZnSO4+SO2↑+2H2O 当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 检验装置的气密性 品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色变成红色 白色粉末变成蓝色 不能 因为混合气体中含H2O会干扰H2的检验
【解析】
本题对Zn与浓H2SO4反应的产物进行两种推测,而后设计装置进行验证;设计时既要验证有无SO2生成,又要验证有无H2生成;验证SO2可用品红溶液,验证H2可利用它的还原性,在加热条件下让气体通过CuO,再通过无水硫酸铜,同时必须注意验证H2时,应考虑空气中的水蒸气和从洗气装置中带出的水蒸气对氢气检验的干扰。
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O;
ZnSO4+SO2↑+2H2O;
(2)反应时浓H2SO4 浓度逐渐变稀,Zn与稀H2SO4 反应可产生H2,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)装置是气体验证实验,所以需要装置气密性完好,实验开始先检验装置的气密性;
(4)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰;
(5)证明生成的气体中含有水蒸气的现象,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色;混合气体中含H2O会干扰H2的检验,所以如果去掉装置B,就不能根据D中的现象判断气体X中有氢气。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为(a/7+1) NAB.所含原子总数为aNA/14
C.燃烧时消耗的O2一定是33.6 a/14LD.所含碳氢键数目为aNA/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为___________。
(2) 装置B的作用为_______________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为________________________。
(3) 仪器F的名称为_________________,E中冷凝水的入口是___________(填“a”或“b”),F的作用为_______________________________________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为____________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是_____
A.重结晶B.过滤 C.蒸馏D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )

A.1:3B.2:3
C.6:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
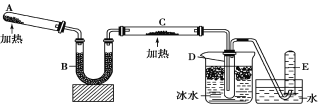
(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是______。
(2)B的作用是______。
(3)C中发生反应的化学方程式是:___,并在方程式中用单线桥标出电子转移的方向和数目___。
(4)D中收集到的物质是___,检验该物质的方法和现象是___;E中收集到的气体是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲和乙均是双液原电池装置,下列说法不正确的是( )
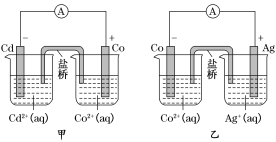
A. 甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
C. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
D. 乙电池中有1mol电子通过外电路时,正极有1mol Ag析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如下反应得到
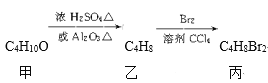
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
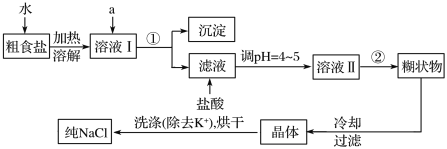
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)欲依次除去溶液Ⅰ中的Mg2+、![]() 、Ca2+,选出a所代表的试剂,按滴加顺序依次为_______溶液、_________溶液、_________溶液。(填化学式)。
、Ca2+,选出a所代表的试剂,按滴加顺序依次为_______溶液、_________溶液、_________溶液。(填化学式)。
(2)分离操作①中所用到的玻璃仪器除了玻璃棒,烧杯,还需要__________________。
(3)加盐酸的作用__________________
(4)实验室里将粗盐制成精盐的过程中,在溶解的操作中要用到玻璃棒,其作用为__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com