
| A、2s22p3 |
| B、3s23p5 |
| C、3s23p4 |
| D、3s23p6 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、H2SiO3 H2S CO2 |
| B、MgSO4 CH3COOH CH3CH2OH |
| C、H2SO3 BaSO4 CH4 |
| D、H2O NH3?H2O H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学概念在逻辑上存在如图所示关系:对下列概念的说法不正确的是
化学概念在逻辑上存在如图所示关系:对下列概念的说法不正确的是| A、纯净物与混合物属于并列关系 |
| B、化合物与氧化物属于包含关系 |
| C、单质与化合物属于交叉关系 |
| D、氧化还原反应与化合反应属于交叉关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体NaCl不导电,但 NaCl是电解质 |
| B、CO2的水溶液导电,但 CO2不是电解质 |
| C、铜、石墨均导电,但它们均不是电解质 |
| D、稀硫酸能导电,所以稀硫酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲烷的电子式 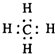 | ||
B、氟化钠的电子式 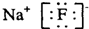 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、碳-12原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2L |
| B、2 L |
| C、1.8 L |
| D、1.5 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴阳离子之间通过静电引力形成的化学键叫离子键 |
| B、共价化合物中不可能含有离子键 |
| C、含有共价键的化合物不一定是共价化合物 |
| D、含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com