
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:填空题
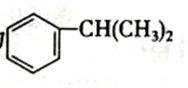
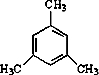 (填结构简式).
(填结构简式).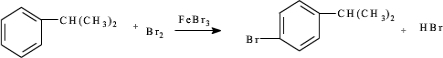 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3molCl2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为2NA | |
| D. | 某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,8.0gSO3体积为2.24L | |
| B. | 物质的量为1molSO2、CO2的混合物所含氧原子数为2NA | |
| C. | 0.1molFeCl3溶液中含有的Fe3+数为0.1NA | |
| D. | 0.5mol镁在空气中完全燃烧所需要的氧气的物质的量为0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中所有原子可以处于同一平面 | |
| B. | Y可命名为邻苯二甲酸二乙酯 | |
| C. | 1mol荧光黄最多可与含3molNaOH的溶液完全反应 | |
| D. | 荧光黄中只有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g丙烷含有碳氢键的数目为NA | |
| B. | 3.9gNa2O2与足量CO2反应转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LH2O中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
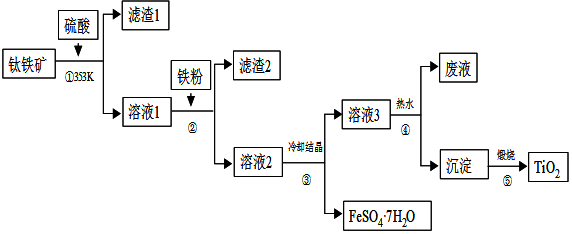
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{W}}{pOH}$ | B. | 10pH | C. | 10-pH | D. | 10pH-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com