
化学在工农业生产和日常生活中都有着重要的应用。下列说法错误的是( )
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.锅炉水垢中含有 的CaSO4,可先用Na2CO3溶液处理,后用酸除去
的CaSO4,可先用Na2CO3溶液处理,后用酸除去
C.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
D.防止酸雨发生的重要措施之一是使用清洁能量
科目:高中化学 来源: 题型:解答题
 )是以烃A为原料经过一系列反应合成的:
)是以烃A为原料经过一系列反应合成的:

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O.
+2NaCl+2H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A.Al3++3NH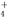 +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B.2Al3++NH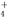 +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
C.Al3++3NH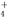 +7OH-===AlO
+7OH-===AlO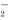 +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
D.Al3++5NH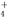 +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO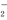 +7H2O
+7H2O
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是( )
A.Cs显+3价
B.CsICl2溶于水,电离生成:Cs+、I-、Cl-
C.在CsICl2溶液中通入Cl2,有单质碘生成
D.酸性高锰酸钾溶液中滴加CsICl2溶液,溶 液褪色
液褪色
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:实验题
KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如下:
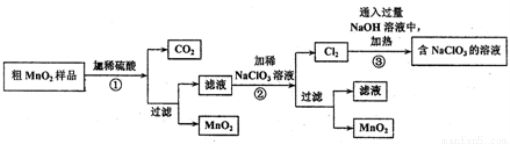
请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为____________。
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为_____________。
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________(填序号)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤。洗涤沉淀所用的玻璃仪器有:_____________,判断是否洗涤干净可选用的试剂是____________(填化学式)。
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为__________。
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为___________。
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2。
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为_______(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:

请将MnO4-氧化C2O42- 的离子方程式补充完整:
______MnO4-+C2O42-+_______=______Mn2++_____CO2↑+_______
请分析KMnO4溶液褪色时间变化的可能原因_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是( )
A. 原子半径的大小顺序:r(Y)> r(Z)>r(W)
B. 元素Z、W的简单离子的电子层结构相同
C. 元素Y 的简单气态氢化物的热稳定性比Z 的强
D. 只含X、Y、Z三种元素的化合物,一定是共价化合物
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(NH4)2Fe( SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
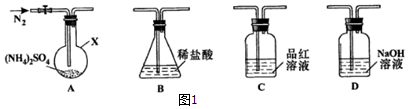
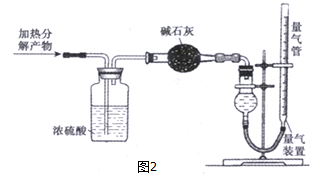
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是 。
①B装置的作用是 。
②M干燥管中所放的药品是 。
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是 (填化学式);检验是否完全变质的实验方法是 。
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+  2Fe3++2SO42-)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
2Fe3++2SO42-)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
实验序号 | 起始读数/mL | 终点读数/mL |
Ⅰ | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①完成上述实验需要准确量取20.00 mL过二硫酸铵溶液,所用仪器的名称是 。
②根据上述数据计算,样品的纯度为  (用含w、c的代数式表示)。
(用含w、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验时,不慎把浓硫酸洒在皮肤上,正确的处理方法是( )
A. 用水冲洗,再涂上硼酸溶液
B. 用氢氧化钠溶液中和,再用水冲洗
C. 用布擦去硫酸后,用稀氢氧化钠溶液冲洗
D. 用大量清水冲洗,再用3%~5%的碳酸氢钠溶液冲洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com