
有四种同族的物质,它们的沸点(p=1.01×105 Pa)如表所示:
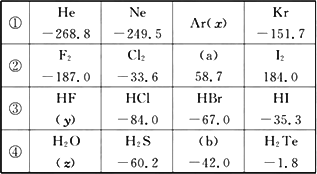
试根据上表回答下列问题:
(1)常温下,a为________色液体;b的分子式为:________.
(2)写出②系列中物质主要化学性质的递变规律________(任写一种).
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________.
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是________.
|
答案:(1)深红棕 H2Se (2)单质的氧化性越来越弱或氢化物的稳定性越来越弱(或其他合理答案) (3)相对分子质量越大,熔沸点越高 (4)HF H2O 分子中含有氢键,所以熔沸点较高 思路点拨:解答本题要明确如下三点: (1)各组物质组成和结构的特点. (2)各组物质沸点的总体变化趋势及其原因. (3)沸点变化反常的物质及其原因. 自主解答:表中所给的是四种同族元素的单质和气态氢化物的沸点,同主族非金属元素的性质随着原子序数的递增,单质的氧化性越来越弱,氢化物的稳定性越来越弱,最高价氧化物对应的水化物的酸性越来越弱.同族非金属元素的单质和气态氢化物的组成和结构相似,随着原子序数的递增,相对分子质量逐渐增大,分子间作用力逐渐增大,熔沸点逐渐升高.但是HF、H2O分子中含有氢键,使沸点反常的高. |


科目:高中化学 来源: 题型:
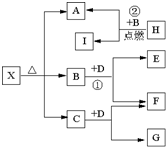 Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 |
| 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
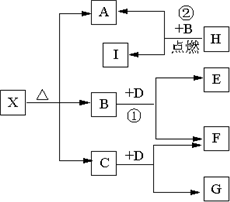 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
 2MgO+C
2MgO+C 2MgO+C
2MgO+C查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三第三次考试(理综)化学部分 题型:填空题
Ⅰ(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子。B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:
(1)写出相应元素符号,A B C E
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴人紫色石蕊试液溶液呈红色,则溶液中离子浓度由大到小的排列顺序为: 。
(3)将铝片和镁片插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
 Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
试回答下列问题
(1)G的化学式为:
(2)写出下列反应的化学方程式
①
②
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的 倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、D、E、G是第1~20号范围内的四种元素,原子序数依次增加,其中A、D同周期, D、E同族,四种元素的原子结构有如下特点:G原子的价电子数是A原子价电子数的2倍;D原子最外层p轨道中的电子数与G原子中的电子层数相同;E原子中未成对电子数与G原子最外层电子数相等。根据以上线索回答:![]()
(1) 元素 A是 ,D是 ,E是 ,G是 。
(2) 由上述部分元素形成的一种水合物在医疗上有重要应用,它是 。
(3) 该物质在医疗上使用时发生变化的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com