
分析 R元素的摩尔质量为:6.88g•cm3×30.1cm3•mol-1=207g/mol,设质子数为x,则x+x+43=207,解得x=82,R元素处于周期表中的位置为第六周期ⅣA族,为Pb元素.在溶液中R2+稳定,R4+具有氧化性,因此可与Fe2+发生氧化还原反应:R4++2Fe2+=R2++2Fe3+.
解答 解:(1)R元素的摩尔质量为:6.88g•cm3×30.1cm3•mol-1=207g/mol,
故答案为:207g/mol;
(2)设质子数为x,则x+x+43=207,解得x=82,故其核电荷数为82,外围电子排布式为:6s26p2,R元素处于周期表中的位置为第六周期ⅣA族,为Pb元素,
故答案为:82;六、ⅣA;Pb;
(3)在溶液中Pb2+稳定,Pb4+具有氧化性,因此可与Fe2+发生氧化还原反应:Pb4++2Fe2+=Pb2++2Fe3+,
故答案为:是,Pb4++2Fe2+=Pb2++2Fe3+;
(4)agR16O2的物质的量为$\frac{ag}{239g/mol}$=$\frac{a}{239}$mol,含有质子物质的量为$\frac{a}{239}$mol×(82+16)=$\frac{98a}{239}$mol,
故答案为:$\frac{98a}{239}$mol.
点评 本题考查了金属元素单质及其化合物性质,题目难度中等,根据题干信息正确推断R的摩尔质量为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH溶解于1 L水中,得到1 mol•L-1的NaOH溶液 | |
| B. | 将11.2 L HCl气体通入水配成0.5 L的溶液,浓度为1 mol•L-1 | |
| C. | 将1 L 10 mol•L-1的盐酸与9 L水混合,混合液浓度为1 mol•L-1 | |
| D. | 10 g NaOH溶解在水中配成250 mL溶液,其浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )| A. | 分子中一定在同一平面上的碳原子至少为5个 | |
| B. | 分子中可能在同一平面上的碳原子最多为8个 | |
| C. | 分子中所有的碳原子有可能都在同一平面上 | |
| D. | 分子中在同一直线上的碳原子数为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g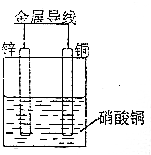 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有氧化性的物质在反应中一定做氧化剂 | |
| B. | 氧化还原反应的实质是电子转移 | |
| C. | 某元素从游离态变为化合态,该元素一定被氧化 | |
| D. | 反应中当有一种元素被氧化时,一定有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com