
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
分析 Ⅰ.(1)二氧化氮和氧气按照4:1溶于水全部生成硝酸;
(2)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
依据盖斯定律计算③×2-②-①得到热化学方程式;
(3)据△H=反应物键能和-生成物键能和求算;
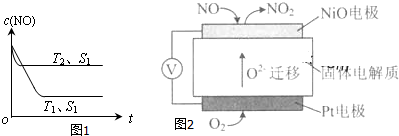
(4)催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图;
Ⅱ.(1)依据图表数据结合化学平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积计算得到;
(2)依据图表数据计算分析判断,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小;
(3)依据平衡浓度之比和30min前达到的平衡浓度比较分析平衡移动方向,结合平衡移动原理判断反应热量变化;
Ⅲ.(1)CO转化率为50%,CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L):0.1 0.2 0
变化浓度(mol/L):0.05 0.1 0.05
平衡浓度(mol/L):0.05 0.1 0.05
则该温度下的平衡常数为 $\frac{0.05}{0.05×0.{1}^{2}}$=100,
再加入1.0mol CO后,可采用极限法计算,假设H2完全转化,则
CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L):0.6 0.2 0
变化浓度(mol/L):0.1 0.2 0.1
平衡浓度(mol/L):0.5 0 0.1
计算一氧化碳转化率判断;
(2)①得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答 解:Ⅰ.(1)NOx能形成酸雨,NO2转化为HNO3的总反应的化学方程式为:4NO2+O2+2H2O═4HNO3,故答案为:4NO2+O2+2H2O═4HNO3;
(2)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
依据盖斯定律计算③×2-②-①得到热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol,
故答案为:-746.5KJ/mol;
(3)△H=反应物键能和-生成物键能和,946kJ/mol+497kJ/mol-2Q(N-O)=180.0kJ/mol,Q(N-O)=631.5KJ/mol,故答案为:631.5;
(4)催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: .
.
Ⅱ.(1)平衡状态物质的平衡浓度为,c(NO)=0.04mol/L;c(N2)=0.03mol/L;c(CO2)=0.03mol/L;K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.03×0.03}{0.0{4}^{2}}$=0.56;
故答案为:0.56;
(2)30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.034mol/L;c(CO2)=0.017mol/L;c(NO)=0.032mol/L;K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.034×0.017}{0.03{2}^{2}}$=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以可能是减小二氧化碳浓度,
故答案为:减小CO2的浓度;
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,和图表数据分析判断,平衡逆向进行,由平衡移动原理可知,升温平衡向吸热反应方向进行,所以正反应为放热反应;反应的△H<0;
故答案为:<;
Ⅲ.(1)CO转化率为50%,CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L):0.1 0.2 0
变化浓度(mol/L):0.05 0.1 0.05
平衡浓度(mol/L):0.05 0.1 0.05
则该温度下的平衡常数为 $\frac{0.05}{0.05×0.{1}^{2}}$=100,
再加入1.0mol CO后,可采用极限法计算,假设H2完全转化,则
CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L):0.6 0.2 0
变化浓度(mol/L):0.1 0.2 0.1
平衡浓度(mol/L):0.5 0 0.1
则重新达到平衡,CO的转化率 $\frac{0.1}{0.6}$×100%=$\frac{1}{6}$<50%,则转化率减小,
故答案为:减小;
(2)①铂电极上氧气得电子生成氧离子而被还原,故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,故答案为:NO+O2--2e-=NO2.
点评 本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象、电极反应式的以及热化学方程式的书写等,注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,溶质在萃取剂中的溶解度应大于在原溶剂中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H20分子中只含有非极性共价键 | |
| B. | H20分子中只含有极性共价键 | |
| C. | 水分子间只存在氢键 | |
| D. | 冷却反应堆用水在地球上常温下是固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①⑤⑥ | C. | ①③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g CO和N2的混合物含有的分子数为 NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为4NA | |
| C. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com