
某中学研究性学习小组的同学对牛奶中的蛋白质进行分析实验:取30mL牛奶(密度为1.03g×cm-3),用盖尔达法分解蛋白质,把氮完全转化为氨,用0.5mol×L-1H2SO4溶液50.0mL吸收后,剩余的酸用38.0mL1.00mol×L-1的NaOH溶液中和。
盖尔达法:![]()
求:(1)30mL牛奶中含有多少克氮?
(2)如果蛋白质中氮元素的质量分数为16.8%,则牛奶中含蛋白质的质量分数为多少?
(1)0.168 (2)3.24% 解析:(1)n(H2SO4)=0.5mol×L-1´0.05L=2.5´10-2mol n(NaOH)=0.038L´1.00mol/L=3.8´10-2mol 又由2NaOH+H2SO4=Na2SO4+2H2O 2NH3+H2SO4=(NH4)2SO4 得:n(NH3)=2´(2.5´10-2mol- 则30mL牛奶中有氮的质量为1.2´10-2mol´14g×mol-1=0.168g (2)30mL牛奶的质量为30mL´1.03g×cm-3=30.9g 又∵ 30mL牛奶中有氮的质量为0.168g,蛋白质中氮元素的质量分数为16.8%,即蛋白质的质量为 则牛奶中含蛋白质的质量分数为
|


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
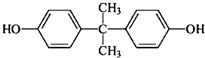 是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).
是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).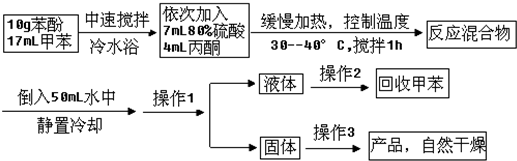
查看答案和解析>>
科目:高中化学 来源: 题型:
A.该井水中肯定有Fe3+
B.该井水中肯定有Fe3+
C.红褐色不溶物是Fe(OH)3
D.红褐色不溶物是由于氧化和水解产生的
查看答案和解析>>
科目:高中化学 来源: 题型:
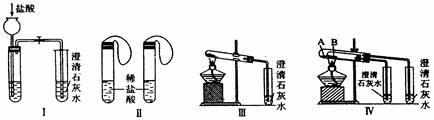
(18分)![]() 某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 ,能说明碳酸钠比碳酸氢钠稳定的实验现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号) 。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据 ;若不能,请简要说明理由 。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(1)当石灰水过量时,反应的离子方程式为 。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 。
实验三、检验“侯氏制碱法”制得的纯碱中是否混有食盐和小苏打。
(1)检验纯碱中是否混有食盐的试剂是 ;
(2)证明纯碱中混有小苏打的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)![]() 某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 ,能说明碳酸钠比碳酸氢钠稳定的实验现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号) 。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据 ;若不能,请简要说明理由 。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(1)当石灰水过量时,反应的离子方程式为 。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 。
实验三、检验“侯氏制碱法”制得的纯碱中是否混有食盐和小苏打。
(1)检验纯碱中是否混有食盐的试剂是 ;
(2)证明纯碱中混有小苏打的实验方法是 。
查看答案和解析>>
科目:高中化学 来源:福建省厦门双十中学2011届高三第一次月考化学试题 题型:填空题
(18分)
|

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com