
A、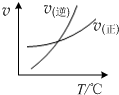 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、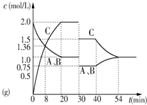 代表等物质的量的气体A和B,在一定温度下发生反应A(g)+B(g)?2C(g),达到平衡后,只改变反应的一个条件,其在20~40 min之间的平衡常数不相等 |
C、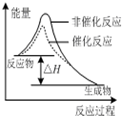 表示该反应为放热反应,且催化剂不能改变反应的焓变 |
D、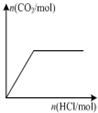 表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
 ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
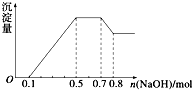 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A、溶液中的阳离子有H+、Mg2+、NH4+、Al3+ |
| B、溶液中n (Al3+)=0.2mol |
| C、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| D、n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe |
| B、FeO |
| C、Fe(OH)3 |
| D、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ba2+ Mg2+ NH4+ Na+ Al3+ |
| 阴离子 | SO42- SO32- C032- AlO2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氮气的容器内冷却 |
| B、在水中冷却 |
| C、在氦气的环境里冷却 |
| D、在二氧化碳气体里冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:
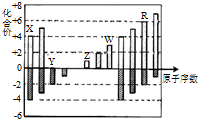
| A、原子半径:Z>W>Y |
| B、Z和Y形成的化合物是离子化合物 |
| C、气态氢化物的稳定性:R<Y |
| D、常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com