
| A、H+、CO32-、Na+ |
| B、NH4+、K+、OH- |
| C、Ag+、Cl-、Na+ |
| D、Na+、NO3-、Cu2+ |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、蒸发 | B、分液 | C、过滤 | D、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4g氦气所含的分子数为0.5NA |
| B、18g H2O所含有的电子数为8NA |
| C、2.3g Na与足量水反应,共失去的电子数为0.1NA |
| D、在20℃,1.01×105Pa时,11.2L O2所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 |
| C、氯化艳晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻10个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为实现2008京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A、该物质可以视为酚类 |
| B、在浓硫酸作用下,分子内消去一个水分子,产物有二种同分异构体 |
| C、能使溴的四氯化碳溶液褪色 |
| D、该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.0045mol?L-1? | <100个?mL-1? |
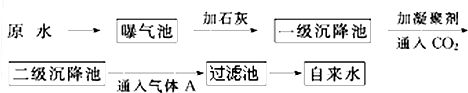
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com