
【题目】碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
![]() 铝的基态原子的价电子排布式是_________________。
铝的基态原子的价电子排布式是_________________。
![]() 用水解法制备一种磁性材料铁氧体时常加入尿素
用水解法制备一种磁性材料铁氧体时常加入尿素![]() 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中![]() 键和
键和![]() 键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
![]() 、
、![]() 等金属离子与
等金属离子与![]() 、
、![]() 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,其原因是__________;已知氨
,其原因是__________;已知氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,联氨
,联氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,解释其熔沸点高低的主要原因:______________。
,解释其熔沸点高低的主要原因:______________。
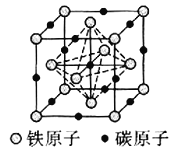
![]() 碳溶解在
碳溶解在![]() 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为![]() ,则晶胞中最近的两个碳原子的距离为__________
,则晶胞中最近的两个碳原子的距离为__________![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() 。
。
【答案】![]()
![]()
![]() sp
sp![]() 、sp
、sp![]() 杂化
杂化 ![]() 锌离子的半径较大且含有的空轨道多于镁离子 联氨分子间形成氢键的数目多于氨分子形成的氢键
锌离子的半径较大且含有的空轨道多于镁离子 联氨分子间形成氢键的数目多于氨分子形成的氢键 ![]()
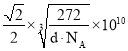
【解析】
![]() 铝为13号元素,它位于元素周期表中第三周期ⅢA族;
铝为13号元素,它位于元素周期表中第三周期ⅢA族;
![]() 同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大;尿素分子的结构式为
同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大;尿素分子的结构式为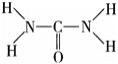 ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键;醋酸钠中甲基中碳原子形成4个
键;醋酸钠中甲基中碳原子形成4个![]() 键、另外碳原子形成3个
键、另外碳原子形成3个![]() 键,均没有孤对电子,杂化轨道数目分别为4、3;
键,均没有孤对电子,杂化轨道数目分别为4、3;
![]() 由于锌离子的半径较大且含有的空轨道多于镁离子;氨气分子之间、联氨分子之间都形成氢键;
由于锌离子的半径较大且含有的空轨道多于镁离子;氨气分子之间、联氨分子之间都形成氢键;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心,均摊法计算Fe、C原子数目确定化学式;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离。
![]() 铝为13号元素,它位于元素周期表中第三周期ⅢA族,其价电子排布式为3s
铝为13号元素,它位于元素周期表中第三周期ⅢA族,其价电子排布式为3s![]() 3p
3p![]() ;
;
![]() 同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大,电负性为
同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大,电负性为![]() ;尿素分子的结构式为
;尿素分子的结构式为 ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中
键,分子中![]() 键与
键与![]() 键的数目之比为
键的数目之比为![]() ;醋酸钠中甲基中碳原子形成4个
;醋酸钠中甲基中碳原子形成4个![]() 键、另外碳原子形成3个
键、另外碳原子形成3个![]() 键,均没有孤对电子,杂化轨道数目分别为4、3,碳原子的杂化方式分别为sp
键,均没有孤对电子,杂化轨道数目分别为4、3,碳原子的杂化方式分别为sp![]() 、sp
、sp![]() 杂化;
杂化;
![]() 由于锌离子的半径较大且含有的空轨道多于镁离子,因此与NH3、N2H4形成的化合物稳定性相对较高的是Zn2+;氨气分子之间、联氨分子之间都形成氢键,但联氨分子之间形成的氢键更多,联氨的熔沸点高于氨气的;
由于锌离子的半径较大且含有的空轨道多于镁离子,因此与NH3、N2H4形成的化合物稳定性相对较高的是Zn2+;氨气分子之间、联氨分子之间都形成氢键,但联氨分子之间形成的氢键更多,联氨的熔沸点高于氨气的;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心,晶胞中Fe原子数目=6×![]() +8×
+8×![]() =4、C原子数目=1+12×
=4、C原子数目=1+12×![]() =4,Fe、C原子数目之比为1:1,故化学式为:FeC;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为r pm,则晶胞棱长=
=4,Fe、C原子数目之比为1:1,故化学式为:FeC;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为r pm,则晶胞棱长=![]() rpm,晶胞质量=dg/cm3×(
rpm,晶胞质量=dg/cm3×(![]() r×10-10cm)3=4×
r×10-10cm)3=4×![]() g,解得r=
g,解得r=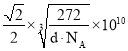 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Aminolevulinic acid是一种新型小分子药物,其结构为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A. Aminolevulinic acid 的分子式是C5H7NO3
B. lmol该分子最多只能与lmol氢气发生加成反应
C. Aminolevulinic acid能发生氧化反应、还原反应和取代反应
D. Aminolevulinic acid分子中含有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol/L的NaOH溶液滴定10mL0.01mol/L的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

c点时溶液中各离子浓度由大到小的顺序为___;
②b点时溶液中c(N2O22-)___c(H2N2O2)(填“>”“<”或“=”);
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =___。
=___。
[已知KSP(Ag2SO4)=1.4×10-5、KSP(Ag2N2O2)=5.6×10-9 ]。
(3)常温下,向b mol/L醋酸钠溶液中滴加等体积的amol/L的盐酸,使溶液恰好呈中性,则醋酸的电离平衡常数=___(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。
(1)氮原子最外电子层上有________种能量不同的电子,其原子核外存在________对自旋相反的电子。
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式:_____________。(Q的数值用含字母a、b的代数式表示)
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。

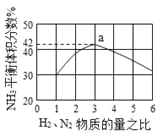
(3)工业上合成氨的温度一般控制在500℃,原因是____________________。
根据图中a点数据计算N2的平衡体积分数为__________。
(4)硫化铵晶体与晶体硅相比较,____________的熔点较高,原因是___________。
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】如右图是元素周期表的一部分。已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn。
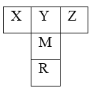
(1)表中五种元素第一电离能最大的是 (填元素符号),Y的最简单氢化物分子的空间构型为 ,基态R原子中有 个未成对电子。
(2)Y的最高价氧化物熔点比M的最高价氧化物熔点低,原因是 ,YZ-中σ键与π键的个数比为 。
(3)YO32-中Y原子的杂化方式是 ,写出一种与YO32-互为等电子体的粒子 (用化学符号表示)。
(4)Z的一种常见氢化物能与硫酸铜反应生成配合物。请用结构简式表示该配合物中的阳离子: 。
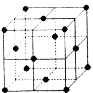
(5)如图为某金属单质的面心立方晶胞结构示意图,该晶体中配位数是 ;测得此晶体的密度为2.7g.cm-3,晶胞的边长为0.405nm,则此金属原子的相对原子质量为 (结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B.香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C.某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
D.青蒿素(![]() )的一氯代物有5种(不含立体异构)
)的一氯代物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
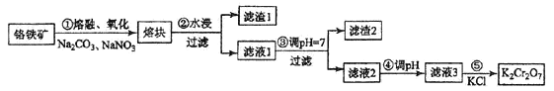
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
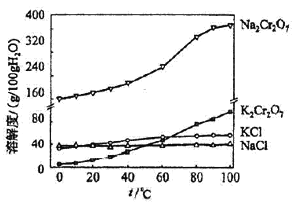
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
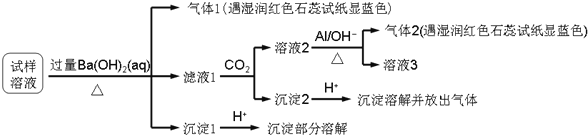
已知:![]() ,根据以上的实验操作和现象,该同学得出的结论不正确的是
,根据以上的实验操作和现象,该同学得出的结论不正确的是![]()
A.试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]()
B.试样中一定不含![]()
C.试样中可能存在![]() 、
、![]()
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com