
| A. | 1mol氯化氢和22.4升氮气 | |
| B. | 2molCO2和3molH2 | |
| C. | 在标准状况下16gO2和16gCH4 | |
| D. | 同温同压下,0.5mol氨气和14克CO气体 |
分析 A.气体状况未知,Vm不确定;
B.依据N=nNA解答;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$判断;
D.依据n=$\frac{m}{M}$计算判断.
解答 解:A.气体状况未知,Vm不确定,无法计算氮气的物质的量,故A错误;
B.依据N=nNA可知分子数与物质的量成正比,所以2molCO2和3molH2,分子数之比为:2:3,故B错误;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$可知,质量相同物质,分子数与M成反比,而氧气与甲烷摩尔质量不同,所以16gO2和16gCH4分子数不相同,故C错误;
D.14克CO气体物质的量为$\frac{14g}{28g/mol}$=0.5mol,依据N=nNA可知气体物质的量相同分子数相同,故D正确;
故选:D.
点评 本题考查了物质的量有关计算,明确物质的结构、以物质的量为核心的计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氧化钠是强电解质,醋酸是弱电解质 | |
| C. | 氨气是弱电解质,铜是强电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2- | B. | Fe3+ | C. | HCO3- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
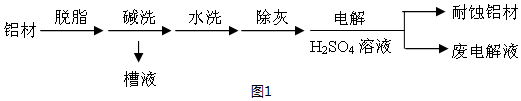
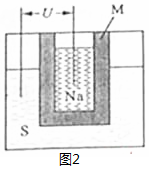
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol/L的溶液:Al3+、CH3COO-、NH4+、HCO3- | |
| B. | 试KSCN溶液变红的溶液:Na+、SO42-、H2O2、Cl- | |
| C. | 使酚酞变红的溶液:Ag(NH3)2+、CO32-、K+、S2- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液:K+、AlO2-、SiO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。已知H2O(l) = H2O(g) ΔH = +44 kJ·mol-1 ,则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:填空题
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:

(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_________L(不考虑二氧化碳的回收利用)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根据上表水解方程式ClO-+H2O?HClO+OH-的平衡常数K≈10-7.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com