

| A. | ①③⑥ | B. | ①②⑤ | C. | ③⑤⑥ | D. | ②③④ |
分析 ①由极性键构成的分子,若结构对称,正负电荷中心重叠,则为非极性分子;
②因S、P能级的电子云形状不同,所以s-s σ键与s-p σ键的电子云形状不同;
③含有π键的化合物,化学键易断裂,性质较活泼断;
④氢键不是化学键;
⑤氢氧化铜能和酸发生中和反应,也能和氨水反应生成络合物;
⑥氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一.这样就有两种可能:(1)H3N…H-O-H;(2)H2N-H…OH2;再根据氨水的电离分析.
解答 解:①由极性键构成的分子,若结构对称,正负电荷中心重叠,则为非极性分子,非极性分子中不一定含有非极性键,如甲烷是正四面体结构,结构对称为非极性分子,分子中只含有极性键,故错误;
②S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故错误;
③含有π键的化合物,化学键易断裂,性质较活泼,含δ键的化合物性质稳定,则化学性质不同,故正确;
④冰中存在极性共价键和氢键两种作用,但氢键不是化学键,故错误;
⑤氢氧化铜能和硝酸、浓硫酸发生中和反应,溶于硝酸、浓硫酸,氢氧化铜能和氨水反应生成络合物离子银氨离子,所以氢氧化铜能溶于氨水中,故正确.
⑥氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一.这样就有两种可能:(1)H3N…H-O-H;(2)H2N-H…OH2;由于一水合氨可电离出NH4+和OH-,所以NH3•H2O的结构式为 ,故正确;
,故正确;
所以正确的为③⑤⑥.
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及常见的实例,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某温度比常温要高 | B. | 前者的c(H+)较后者大 | ||
| C. | 水的电离过程是一个放热过程 | D. | 某温度下,pH=7时的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、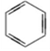 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 22.4 mol/L | C. | 0.045 mol/L | D. | 0.03 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 氢氧化铜可溶于氨水说明氢氧化铜是两性氢氧化物 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )
Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )| A. | a电极是该电池的负极 | |
| B. | b电极发生氧化反应 | |
| C. | b电极的电极反应式为:2AgCl+2e-=2Ag+2Cl- | |
| D. | 电池工作时,电子从a电极经外电路流向b电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com