
分析 (1)I2与Na2SO3发生氧化还原反应;
(2)反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平;K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,反应中Mn元素化合价分别由+6价升高到7价、降低到+4价,由氧化还原反应氧化剂和还原剂之间得失电子数目相等可知;
(3)酸性条件下K2Cr2O7氧化乙醇生成硫酸钾、硫酸铬、乙酸和水.
解答 解:(1)I2与Na2SO3发生氧化还原反应,反应的离子方程式为SO32-+I2+H2O═2I-+SO42-+2H+,故答案为:SO32-+I2+H2O═2I-+SO42-+2H+;
(2)二氧化锰与KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3 $\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,反应中Mn元素化合价分别由+6价升高到7价、降低到+4价,由氧化还原反应氧化剂和还原剂之间得失电子数目相等可知,生成KMnO4和MnO2的物质的量之比为2:1;
故答案为:3MnO2+KClO3+6KOH$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O; 2:1;
(3)酸性条件下K2Cr2O7氧化乙醇生成硫酸钾、硫酸铬、乙酸和水,反应的化学方程式为2K2Cr2O7+3CH3CH2OH+8H2SO4═2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,
故答案为:2K2Cr2O7+3CH3CH2OH+8H2SO4═2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意计算时存在的物质的量关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学键的形成需释放能量 | |
| B. | 化学反应过程中,化学能一定转化成热能 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 反应条件是加热的反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们基于盐沸点较高的特性制作食物,如盐炯鸡等 | |
| B. | 基于醋的酸性,人们制作出了酪掩食品.如掩黄瓜、腌蒜等 | |
| C. | 碳酸饮料需低温保存是因为温度越低溶于水中的二氧化碳就越多 | |
| D. | 鱼腥味的罪魁祸首是鱼体内的碱性物质,做鱼时加入少量醋可发生中和反应清除异味. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HBr+Na2CO3═2NaBr+H2O+CO2↑ | B. | 2HBr+CaCO3═CaBr2+H2O+CO2↑ | ||
| C. | HBr+NaOH═NaBr+H2O | D. | 2HBr+2Ag═AgBr+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
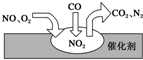 2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )
2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总反应为2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com