
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 ①电解精炼铜时,阳极上放电的不止是铜;
②NH4HSO4溶液中含有的H+对铵根离子的水解有抑制作用;
③根据电子守恒,0.2mol锌,转移0.4mol电子,生成1mol氢气或二氧化硫电子转移都是2mol;
④H2SiO3胶粒是多个H2SiO3的聚集体;
⑤SO2和O2的反应为可逆反应;
⑥由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒来分析.
解答 解:①电解精炼铜时,活泼金属优先在阳极上失去电子,粗铜中铁、锌等杂质摩尔质量小于铜的,6.4g金属失去的电子大于0.2mol,转移的电子数目大于0.2 NA,故错误;
②NH4HSO4能完全电离出NH4+、H+和SO42-,溶液呈强酸性,H+能抑制NH4+的水解,故NH4HSO4中NH4+的水解程度小于NH4Cl中NH4+的水解程度,故1L 1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4HSO4溶液含NH4+数目前者多,故错误;
③Zn的物质的量是0.2mol,无论生成氢气还是二氧化硫,1mol气体得到2mol电子,0.2mol锌可以反应生成0.2mol气体,气体分子数必为0.2NA,故正确;
④H2SiO3胶粒是多个H2SiO3的聚集体,故将2mL0.5 mol•Lˉ1Na2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数小于0.001NA,故错误;
⑤SO2和O2的反应为可逆反应,不能进行彻底,故所得体系中分子个数大于2NA个,故正确;
⑥由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒可知:n(CH3COO-)+n(OH-)=n(H+)+n(Na+),由于溶液显中性,故有n(OH-)=n(H+),则有:n(CH3COO-)=n(Na+)=1mol,则醋酸根的个数为NA个,故正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 质量数是1 | C. | 电子数是3 | D. | 中子数是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)<r(Y)<r(W) | |
| C. | W的简单氢化物的热稳定性比Z的强 | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:m>n | B. | 氢化物的稳定性:n>p | ||
| C. | q的最高价氧化物的水化物为强酸 | D. | n在自然界中能以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
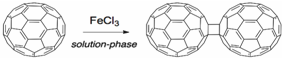

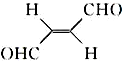 ,下列叙述正确的有AD.
,下列叙述正确的有AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料脱硫、脱硝处理 | B. | 工业废水经处理达标排放 | ||
| C. | 废电子产品统一回收处理 | D. | 农作物秸秆就地露天焚烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不含NO3-,也不含Fe3+ | B. | 含有NO3-、I-、Cl- | ||
| C. | 含I-,不含Cl- | D. | 含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com