
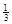 Na3AlH6 (s)+
Na3AlH6 (s)+ 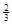 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1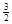 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1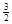 H2(g) ΔH= 。
H2(g) ΔH= 。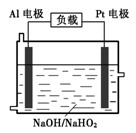
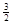 H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.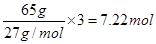 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。

科目:高中化学 来源:不详 题型:单选题
| A.Al既可用于食品包装,也可用做建筑材料 |
| B.Al2O3既可用来冶炼金属Al,也可用做耐火材料 |
| C.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂 |
| D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
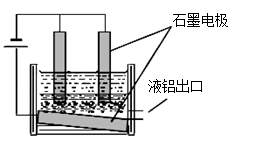
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾水解生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.高温电解Al2O3可制得金属铝 |
| C.MgO的熔点很高,可用于制作耐高温材料 |
| D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.9g | B.2.7g | C.1.8 g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.200 mL | B.225mL | C.300 mL | D.325 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
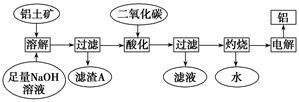
| A.浓硫酸 | B.稀硫酸 | C.稀硝酸 | D.浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com