
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
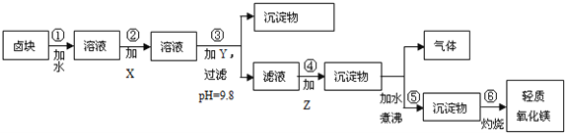
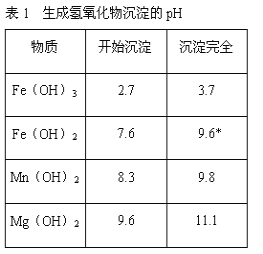
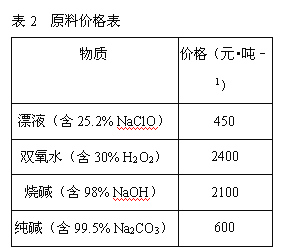
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
【答案】VIII d [Ar]3d6 漂液NaClO 2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O 烧碱 使Mg2+以外的杂质离子转化成沉淀除去 水解反应 Mg(OH)2 ![]() MgO+H2O
MgO+H2O
【解析】
(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)要加入的X为双氧水或次氯酸钠,结合成本选择;
步骤②中pH=1时Fe2+被氧化生成Fe3+;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化锰在pH为9.8时沉淀完全;
(4)根据MgCO3的水解及Mg(OH)2的热稳定性分析。
(1)铁位于周期表中的第四周期,第Ⅷ族,d区,属于过渡元素;铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar] 3d6;
(2)要加入的X为双氧水或次氯酸钠,根据反应的原理可以看出,次氯酸钠作为氧化剂反应后生成氯化钠杂质,而过氧化氢生产的是水,且双氧水的价格高于漂液NaClO,所以加入漂液NaClO;
步骤②中pH=1时Fe2+被氧化生成Fe3+,所发生反应的离子方程式为2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化锰在pH为9.8时沉淀完全,故要控制pH=9.8,所以本题答案为:氢氧化钠,使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的;
(4)步骤⑤反应的化学方程式为:MgCO3+H2O![]() Mg(OH)2+CO2↑,发生的反应是水解反应,步骤⑥是氢氧化镁受热分解生成氧化镁和水,反应的化学方程式为Mg(OH)2
Mg(OH)2+CO2↑,发生的反应是水解反应,步骤⑥是氢氧化镁受热分解生成氧化镁和水,反应的化学方程式为Mg(OH)2 ![]() MgO+H2O。
MgO+H2O。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
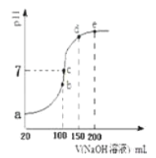
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )

A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表述正确的是![]()
①常温时![]() 的KOH溶液与
的KOH溶液与![]() 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液![]()
②二氧化硅是酸性氧化物,但它能与某种酸反应
③![]() ,
,![]() 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:![]()
⑥![]() 的燃烧热为
的燃烧热为![]() ,则表示
,则表示![]() 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为![]() 。
。
A.①④B.①②C.④⑥D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。

下列说法正确的是
A.室温时,HA的电离度约为10-6
B.图中B点时,溶液的Kw略大于1×10-14
C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-)
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备![]() 的反应:
的反应:![]() ,在体积为1L的恒容密闭容器中,充2molCO和
,在体积为1L的恒容密闭容器中,充2molCO和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
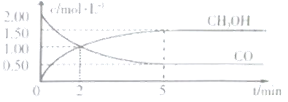
①从反应开始到5min,用一氧化碳表示的平均反应速率υ(CO)=______。
②下列说法正确的是______。
A.达到平衡时,![]() 的转化率为
的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氨气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应:
以体积比1:2置于密闭容器中发生反应:
![]() ,达到平衡时
,达到平衡时![]() 的体积分数为
的体积分数为![]() ,该反应的平衡常数
,该反应的平衡常数![]() ______。
______。
(3)碳与水蒸气反应制取![]() 的相关反应如下:
的相关反应如下:
Ⅰ![]()
Ⅱ![]()
Ⅲ![]()
①计算反应![]() 的
的![]() ______
______![]()
②对于可逆反应![]() ,采取以下措施可以提高
,采取以下措施可以提高![]() 产率的是______。
产率的是______。
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(4)以甲醇为燃料,![]() 为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]() 。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
(5)若往20mL![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
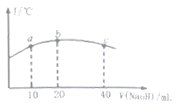
①该烧碱溶液的浓度为![]()
②该烧碱溶液的浓度为![]()
③![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com