
分析 依据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$,c=$\frac{n}{V}$,结合1个水分子含有1个氧原子,10个电子,1个硫酸分子含有4个氧原子,50个电子解答.
解答 解:解:5.4g水的物质的量=$\frac{5.4g}{18g/mol}$=0.3mol,硫酸与水所含分子数目相等,则二者物质的量相等,故硫酸的质量=0.3mol×98g/mol=29.4g;
所含氧原子数之比等于分子中含有氧原子数目之比,故所含氧原子数之比=1:4,所含电子数之比为:n(H2O)×10:n(H2SO4)×50;
水分子与硫酸分子的物质的量相等,则二者所含有电子数之比为:10:50=1:5,将上述硫酸配成500mL溶液,所得溶液的溶质的物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L;
故答案为:29.4;1:4;1:5;3mol/L.
点评 本题考查了物质的量有关计算,明确以物质的量为核心的计算公式,熟悉物质的结构组成是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρV}{MV+2240}$mol/L | B. | $\frac{1000ρV}{MV+2240}$mol/L | ||
| C. | $\frac{MV}{22.4V+0.1ρ}$mol/L | D. | $\frac{V}{2.24}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和NaOH溶液 | B. | NaOH溶液和CO2 | ||
| C. | Na和O2 | D. | Na2CO3溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2中电子数为4NA | |
| B. | 3.4gNH3中含原子总数为0.6 NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量约为28g | |
| D. | 标况下,33.6 L的四氯化碳中,四氯化碳分子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ Na+ NO3- Cl- | B. | Na+ K+ CO32- H+ | ||
| C. | Ba2+Cu2+ SO42- OH- | D. | Cu2+ K+ CO32- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
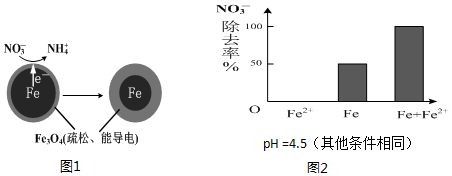 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 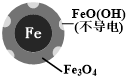 | 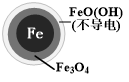 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ NH4+ Cl- | B. | Fe3+Fe2+SO42- | ||
| C. | K+Fe3+NO3- | D. | Na+Fe2+ Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 受热时的稳定性:Na2CO3>NaHCO3 | |
| B. | 使酚酞试液变红的程度:Na2CO3>NaHCO3 | |
| C. | 与同浓度同体积HCl反应产生气泡的速率:Na2CO3<NaHCO3 | |
| D. | 同物质的量与足量HCl反应生成CO2的量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 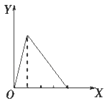 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| B. | 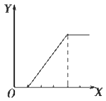 向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡W | |
| C. |  向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量8 | |
| D. | 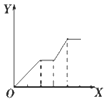 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com