
【题目】反应SO2+O2=2SO3在密闭容器中进行。下列关于该反应的说法正确的是
A. 增大压强能减慢反应速率
B. v(SO2):v(O2)=2:1证明该反应已达到化学平衡状态
C. 当反应物和生成物浓度不变时,反应已达平衡
D. 增大02的浓度可使SO2完全转化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示
请根据所学知识与本题所给信息回答下列问题
(1)H的结构简式是_____________;(2)反应③和④的类型分别是_____________、_____________
(3)反应⑤的化学方程式是__________________________
(4)阿司匹林中含氧官能团的名称为__________________________
(5) 的一种同系物
的一种同系物 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成 最合理的方案。_______________
最合理的方案。_______________
例:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:
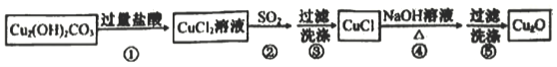
已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵品体[(NH4)2Fe(SO4)2·6H2O]又称摩尔盐,是一种重要的化工原料,用途十分广泛。
(1)基态Fe2+的核外电子排布式为_____________________。
(2)氨是合成摩尔盐的重要原料,工业合成氨中,原料气在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收其中的杂质CO气体,其反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
①醋酸中碳原子的杂化方式是_________,1mol乙酸分子中含有σ键的数目为_________________。
②C、N、O三种元素的第一电离能由小到大的顺序为___________________________。
③与CO互为等电子体的分子为___________(填化学式),NH3的空间构型为__________________。
(3)N和P都是第VA族元素,其最简单氢化物熔点的大小关系为_________,主要原因是__________________________________。
(4)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是____________________(至少答两条)
(2)步骤Ⅱ中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为______(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为:NH3﹒H2O+H+==NH4+ +H2O、__________________、___________________。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是_______________________。
(4)滤液2中,c(Co2+) :c(Ni2+)=_______________。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,假设滤渣1为含铁元素的纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为_________(用含a、b、c的式子表达,无需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质①NaCl晶体②CO2③液态的纯醋酸④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧氨水,请回答下列问题(填序号)
(1)能导电的是
(2)属于电解质的是
(3)属于非电解质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列科研成果不是由我国发明或创造的是( )
A.世界上第一个由人工合成的、具有生理活性的蛋白质﹣﹣结晶牛胰岛素
B.黑火药和造纸
C.发现元素周期律
D.青蒿素的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com