
 ;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.
;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.分析 由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,则氧化剂和还原剂都是NF3,NO易与空气中氧气反应生成红棕色的NO2气体,反应物可用碱液吸收,以此解答该题.
解答 解:(1)NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,氧化还原反应中氧化剂和还原剂得失电子数目相等,则被氧化与被还原的元素的物质的量之比为1:2,
故答案为:1:2;
(2)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,电子方向和数目可表示为 ,
,
由方程式可知若反应中生成0.2mol HNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,转移的电子数目为0.4NA个,
故答案为: ;0.4NA;
;0.4NA;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,可用NaOH等溶液吸收,
故答案为:有红棕色气体和白雾产生;NaOH.
点评 本题考查含氮化合物的性质以及氧化还原反应,为高频考点,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:碳酸>苯酚 |
| B | 向1mL 0.1mol•L-1 MgSO4溶液中,滴入2滴0.1mol•L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C | 向蛋白质溶液中加入甲醛溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
| D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气是可再生资源,电能是二次能源 | |
| B. | 对“地沟油”进行蒸馏即可得到汽油 | |
| C. | 用焦炭还原铝土矿即可获得金属铝 | |
| D. | 从海水提取物质都必须通过化学反应方可实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度为 0.1mol•L-1CH3COONa与HCOONa 溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量0.l mol•L-1AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硅原子最外层有4个电子 | |
| B. | 太阳能电池是一种化学电源 | |
| C. | 太阳能电池实现了光能向电能的转化 | |
| D. | B电极为电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| C | KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -CH3(甲基)的电子式为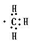 | B. | 乙烯分子的结构简式:CH2CH2 | ||
| C. | H2O分子的球棍模型: | D. | 氟的原子结构示意图: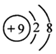 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制铝:电解熔融态氯化铝 | B. | 制铁:以铁矿石为原料,CO还原得铁 | ||
| C. | 制镁:电解熔融态氯化镁 | D. | 制钠:电解熔融态氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1 | B. | 0.5mol•L-1 | C. | 0.54mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com