
| A. | P、S、Cl最高正价依次升高 | |
| B. | Li、Be、B原子最外层电子数逐渐增多 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
分析 A.P、S、Cl位于同一周期,最外层电子数逐渐增大,最高化合价逐渐增大;
B.Li、Be、B位于第二周期,原子序数逐渐增大,最外层电子数逐渐增多;
C.N、O、F位于同一周期,原子序数越大,原子半径越小;
D.同一主族元素,随着原子序数逐渐增大,金属性逐渐增强.
解答 解:A.P、S、Cl的最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7,最高正价依次升高,故A正确;
B.Li、Be、B原子最外层电子数分别为1、2、3,它们的最外层电子数逐渐增多,故B正确;
C.N、O、F位于第二周期,原子序数逐渐增大,则三种原子的原子半径逐渐减小,故C错误;
D.Li、Na、K、Rb位于同一主族,它们的原子序数逐渐增大,金属性逐渐增强,故D正确;
故选C.
点评 本题考查了原子半径与元素周期律的关系及应用,题目难度不大,明确元素周期律内容为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 32 | C. | 48 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
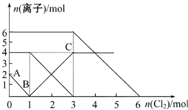 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>Br->I- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是高纯度的单质硅 | |
| B. | 硅在地壳中的含量仅次于氧,自然界中存在大量单质硅 | |
| C. | 硅的化学性质不活泼,常温下不与任何物质起反应 | |
| D. | 硅同素异形体有晶体硅和无定形硅,晶体硅是灰黑色有金属光泽的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 小苏打与烧碱溶液反应 HCO3-+OH-═CO2↑+H2O | |
| C. | Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com