
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为
A. 1.0 mol/L B. 2.0 mol/L C. 3.0 mol/L D. 4.0 mol/L
【答案】B
【解析】试题分析:把1.0mol/LCuSO4和1.0mol/L Fe2(SO4)3溶液等体积混合,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=![]() ×1.0mol/L=0.5mol/L,c(H2SO4)=
×1.0mol/L=0.5mol/L,c(H2SO4)=![]() ×1.0mol/L=0.5mol/L,
×1.0mol/L=0.5mol/L,
混合后溶液中硫酸根来源于硫酸铜与硫酸铁电离,故 c(SO42-)=c(CuSO4)+3c[Fe2(SO4)3]=0.5mol/L+3×0.5mol/L=2mol/L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=2mol/L,故选B。


科目:高中化学 来源: 题型:
【题目】3.6g烃A和Cl2发生取代反应,控制条件使其生成一氯代物,将反应生成的气体用NaOH溶液中和恰好和0.1molL﹣1NaOH溶液500mL完全反应,试解答下列问题:
(1)求链烃A的相对分子质量 .
(2)若A既不能使酸性KMnO4溶液褪色又不能使溴水褪色,试求该烃的分子式 , 并写出符合该分子式的所有可能的同分异构体的结构简式 .
(3)若A的一氯代物只有一种,试确定A的结构简式并用系统命名法命名、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g)△H=﹣92.3kJmol﹣1 , 则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
A.+184.6kJmol﹣1
B.﹣92.3kJmol﹣1
C.﹣369.2kJmol﹣1
D.+92.3kJmol﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A. 铁与稀盐酸反应:2 Fe+6H+=2Fe3++3H2↑
B. 氢氧化钠溶液与盐酸反应:OH-+H+=H2O
C. 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
D. 氯化钡溶液与稀硫酸反应:SO42-+Ba2+= BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 因SiO2不溶于水,故SiO2不是酸性氧化物
B. 在反应SiO2+2C![]() Si+2CO↑中,SiO2作氧化剂
Si+2CO↑中,SiO2作氧化剂
C. SiO2是一种空间立体网状结构的晶体,熔点高,硬度大
D. 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]2H2O}制备流程如图1: 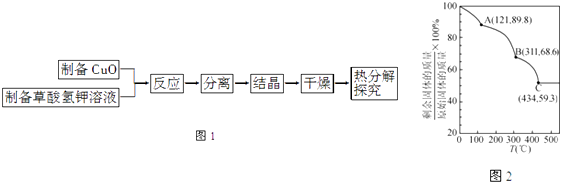
(已知H2C2O4 ![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO47H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 5.8 | 8.8 |
Ⅱ.提供的试剂有:a.蒸馏水 .稀硫酸 .H2O2溶液 d.纯净的Cu(OH)2粉末 .氨水
需经过的步骤有:①、②、③、④过滤得CuSO4溶液.
(5)将制得的K2[Cu(C2O4)2]2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2Na2O2+2H2O===4NaOH+O2↑,下列说法中正确的是 ( )。
A. Na2O2是氧化剂,H2O是还原剂
B. Na2O2既是氧化剂,又是还原剂
C. 该反应中电子转移的数目为4e-
D. 氧气是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com