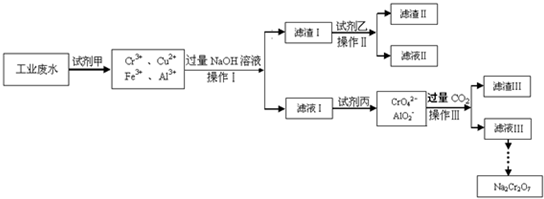
解:(1)由操作流程图可知,操作Ⅰ是分离难溶性固体和液体的方法,故该操作名称为:过滤;操作I、II、III均是过滤的过程,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:过滤;玻璃棒;
(2)向含有Cr
3+、Cu
2+、Fe
3+和Al
3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,滤液是根据题意信息Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O,所以试剂乙可以将氢氧化铜沉淀溶解掉,应为氨水,
故答案为:Cu(OH)
2、Fe(OH)
3;氨水;
(3)在电镀铬的工业废水中主要含有Cr
3+,同时还含有少量的Cu
2+、Fe
2+ Fe
3+和Al
3+等,加入试剂甲以后废水的成分含有Cr
3+、Cu
2+、Fe
3+和Al
3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,故答案为:将Fe
2+氧化成Fe
3+;
(4)向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,即2H
2O+A1O
2-+CO
2=Al(OH)
3↓+HCO
3,
故答案为:2H
2O+A1O
2-+CO
2=Al(OH)
3↓+HCO
3-.
(5)用Fe为电极进行电解生成Fe
2+,作为还原剂还原Cr
2O
72-,而铜电极作阳极生成Cu
2+不能还原Cr
2O
72-,故不用Cu电极来代替Fe电极,故答案为:不能;因阳极产生的Cu
2+不能使Cr
2O
72-还原到低价态;
(6)m(Cr)=1000×1000×(104.5-0.5)=1.04×10
8mg=1.04×10
5g
则Cr的物质的量是2×10
3mol,设Fe为xmol.
14H
++Cr
2O
72-+6Fe
2+=6Fe
3++2Cr
3++7H
2O
6 2
x 2×10
3mol
则
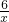
=
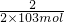
解得x=6×10
3mol,所以m(Fe)=n?M=336×10
3g=336kg,故答案为:336.
分析:(1)由操作流程图可知,操作Ⅰ是分离难溶性固体和液体的方法;
(2)根据氢氧化钠和各个离子之间的反应来确定产物,试剂乙可以将氢氧化铜沉淀溶解掉;
(3)根据溶液中离子种类的变化来分析;
(4)向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠;
(5)用Fe为电极进行电解生成Fe
2+,作为还原剂还原Cr
2O
72-;
(6)根据反应方程式计算.
点评:本题是一道综合知识题目,涉及实验操作,氧化还原反应,电解池等,考查学生分析和解决问题的能力,难度较大.

 NaCrO2
NaCrO2 Na2CrO4
Na2CrO4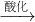 Na2Cr2O7
Na2Cr2O7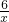 =
=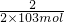 解得x=6×103mol,所以m(Fe)=n?M=336×103g=336kg,故答案为:336.
解得x=6×103mol,所以m(Fe)=n?M=336×103g=336kg,故答案为:336.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.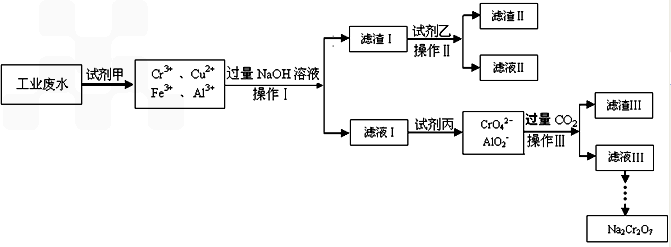
 NaCrO2
NaCrO2  Na2CrO4
Na2CrO4 Na2Cr2O7
Na2Cr2O7 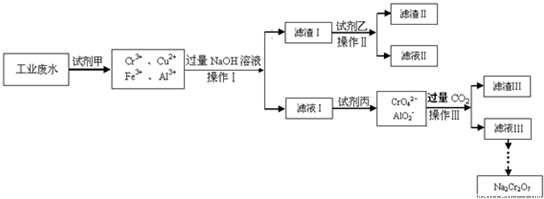
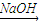 NaCrO2
NaCrO2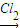 Na2CrO4
Na2CrO4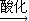 Na2Cr2O7
Na2Cr2O7