
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
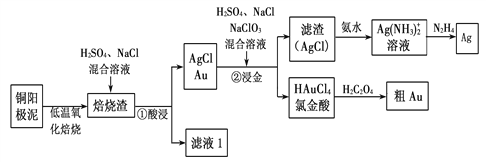
(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):
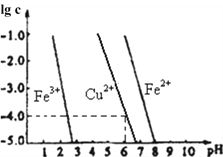
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
【答案】 +3 Ag2O + 2H+ +2Cl- ![]() 2AgCl+H2O 高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O
2AgCl+H2O 高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O![]() 4Ag+O2) 8 2HAuCl4 + 3H2C2O4
4Ag+O2) 8 2HAuCl4 + 3H2C2O4 ![]() 2Au + 8HCl + 6CO2↑ 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
2Au + 8HCl + 6CO2↑ 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
【解析】分析:本题考查化学工艺流程,各步生产流程中通过过滤分离固体和溶液。通过得失电子守恒和原子守恒配平化学方程式,依据化学方程式进行计算;依据溶度积公式计算溶度积。
详解:(1)氯金酸(HAuCl4)中的H元素为+1,Cl元素为-1,由化合价代数和为0得到Au元素的化合价为+3;
(2)由流程图可知,“焙烧渣”在“①酸浸”时,Ag2O与盐酸反应生成AgCl和H2O,反应的离子方程式为Ag2O +2H++2Cl-==2AgCl+H2O;
因为Ag2O高温焙烧分解为Ag和O2,所以铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是防止反应生成的Ag2O又分解为Ag和O2;
(4)由题意可知,N2H4被Ag(NH3)2+氧化为N2,Ag(NH3)2+被N2H4还原为Ag,反应的离子方程式为:4Ag(NH3)2++ N2H4 + 4OH-![]() 4Ag+N2+4H2O+8NH3;每生成1molAg,需要消耗0.25mol N2H4,质量为0.25mol×32g/mol=8g。
4Ag+N2+4H2O+8NH3;每生成1molAg,需要消耗0.25mol N2H4,质量为0.25mol×32g/mol=8g。
(5)由题意可知,酸性条件下HAuCl4被草酸还原为Au,草酸被HAuCl4氧化为二氧化碳,反应的化学方程式为:2HAuCl4+ 3H2C2O4![]() 2Au + 8HCl + 6CO2↑。
2Au + 8HCl + 6CO2↑。
(6)①要从浸出液中提纯铜,需要先将Fe2+氧化为Fe3+ ,然后加入适量的CuO调节pH=3.7,生成氢氧化铁沉淀,除去Fe3+ 离子;②Ksp[Cu(OH)2]=c(Cu2+)c2(OH-),由图可知,pH=6时,lgc(Cu2+)=-4,c(Cu2+)=10-4mol/L,c(OH-)=10-8mol/L,Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=10-4×(10-8)2=1.0×10-20,因此,本题答案为:将Fe2+氧化为Fe3+ ; Fe3+ ; 1.0×10-20。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种重要的有机合成中间体,由化合物A合成H的一种路线如下:
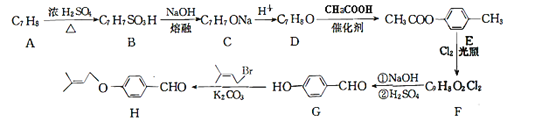
已知:RCHCl2 ![]() RCHO回答下列问题:
RCHO回答下列问题:
(1)A的化学名称为___________。
(2)G生成H的反应类型为__________,F中官能团名称是_____________。
(3)由A生成B的化学方程式____________________________,合成过程中D生成E的作用是_____________________。
(4)满足下列条件的H的同分异构体有________种,写出其中核磁共振氢谱有4组峰,且峰面积比为6:2:2:1:1:1:1的结构简式___________。
①能够发生银镜反应,能够发生水解反应,水解后的产物能与FeCl3溶液发生显色反应
②分子中只有一个环 ③苯环上有两个取代基,分子中含有两个甲基。
(5) 己知![]() ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的路线__________。
的路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I (分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。
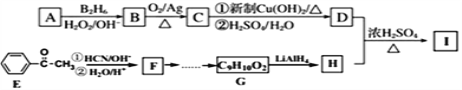
已知:①![]() ;
;![]()
②有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;有机物H是苯甲醇的同系物,苯环上只有一个侧链。回答下列问题:
(1)用系统命名法命名有机物A___________________;
(2)B的结构简式为_____________________________________;
(3)F→G经历两步反应,反应类型依次为____________,_____________。
(4)C→D第①步反应的化学方程式为_________________________________。
(5)F在一定条件下能形成一种聚酯类化合物,写出该反应的化学方程式___________________________________________________________。
(6)己知有机物甲符合下列条件:①为芳香族化合物;②与H互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有_______种, 写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式_______;
(7)参照上述合成路线以丙酮等为原料合成D (无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol/L的一元碱BOH与等浓度盐酸等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )
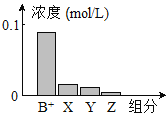
A.BOH为强碱
B.该混合液pH=7
C.该混合溶液中:c(B+)+c(Y)=c(Cl-)
D.图中X表示BOH,Y表示H+,Z表示OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种新型有机酰胺,在工业生产中有重要的作用,其合成路线如下:
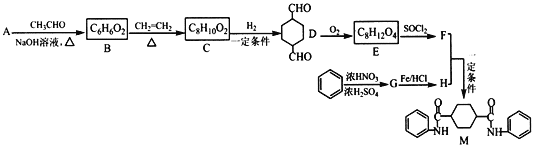
已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应,且5.8gA完全发生反应生成0.4mol银。
回答下列问题:
(1)E的结构简式为_____________;G的名称为_______________。
(2)B中含有官能团的名称为________________________________。
(3)C-D的反应类型为_______________________________________。
(4)写出 F+H→M的化学反应方程式__________________________。
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCI3溶液发生显色反应。0.5 mol W可与足量的Na反应生成1 g H2,且核磁共振氢谱显示为五组峰,符合以上条件的W的同分异构体共有_______ 种,写出其中一种的结构简式___________________。
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备![]() 的合成路线___________________。
的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是
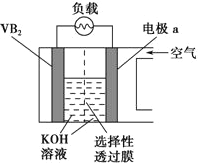
A. 电极a为电池负极
B. 反应过程中溶液的pH升高
C. 电池连续反应过程中,选择性透过膜采用阳离子选择性膜
D. VB2极的电极反应式为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com