
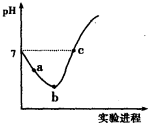
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol?L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol?L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A、实验进程中可用pH试纸测定溶液的pH | ||
| B、c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | ||
| C、向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | ||
D、由a点到b点的过程中,溶液中
|
| c(H+) |
| c(ClO-) |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②⑤ | C、①③ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
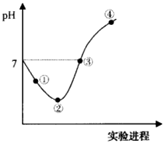 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A、②点之前所发生反应的离子方程式为:Cl2+H2O=2H++Cl-+ClO- | B、③点所示溶液中:c(Na+)=c(HClO)+2c(ClO-) | C、实验进程中溶液的pH可以用pH试纸测得 | D、曲线的起始点水的电离程度最大 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济宁市高三第一次模拟理综化学试卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
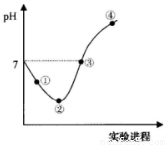
A.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO﹣
B.③点所示溶液中:c(Na+)= c(HClO)+2c(ClO-)
C.实验进程中溶液的pH可以用pH试纸测得
D.曲线的起始点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com