
【题目】吉林某化工厂发生爆炸,导致1个硝基苯储罐、2个苯储罐报废,导致苯酚、苯胺停产。爆炸过程还产生了大量的浓烟和强烈的刺激性气味,造成了空气污染。
(1)写出上述材料中提到的4种有机物中,任意两种有机物的结构简式①_______,②_________。
(2)爆炸过程中,产生了大量黑烟,其原因是_____________
(3)上述爆炸事故附近的江水有强烈苦杏仁气味,苯、硝基苯、二甲苯等主要污染物指标均超过国家标准。具有苦杏仁味的有机物是________,它在江水中的主要存在形式是___________。
(4)硝基苯是制造染料的重要原料,但是硝基苯进入人体,严重危害人体健康,写出实验室由苯制取硝基苯反应的化学方程式_________________。
【答案】![]()
![]() 有机物燃烧不完全 硝基苯 沉在江水底部
有机物燃烧不完全 硝基苯 沉在江水底部 ![]() +HO-NO2
+HO-NO2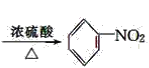 +H2O
+H2O
【解析】
(1)四种有机物为:苯、硝基苯、苯胺、苯酚;
(2)有机物中含有碳元素,如果碳元素不完全燃烧,会有黑烟生成;
(3)根据硝基苯的物理性质回答;
(4)苯和浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯和水,据此写化学方程式;
(1)四种有机物为:苯、硝基苯、苯胺、苯酚,写出任意两种的结构简式,比如苯和硝基苯的结构简式为![]() 、
、![]() ;
;
答案:![]()
![]()
(2)有机物中含有碳元素,如果碳元素不完全燃烧,会有黑烟生成,所以爆炸过程中,产生了大量黑烟,其原因是有机物不完全燃烧;
答案:有机物燃烧不完全
(3)苯、硝基苯、二甲苯中含有苦杏仁味的是硝基苯;硝基苯是有苦杏仁味的油状液体,难溶于水,密度比水大;
答案:硝基苯;沉在江水底部
(4)苯和浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯和水,反应方程式为 ![]() +HO-NO2
+HO-NO2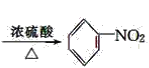 +H2O;
+H2O;
答案:(6). ![]() +HO-NO2
+HO-NO2 +H2O
+H2O


科目:高中化学 来源: 题型:
【题目】早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________,属于_____区,基态Ag原子的价电子排布式为__________。
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是______(填名称),配体阴离子的空间构型是______,中心原子采用_____杂化。
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4_____ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为______(用化学式表示),其结构原因是______。
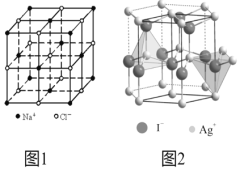
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为______,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______。
a. 几何因素 b. 电荷因素 c. 键性因素
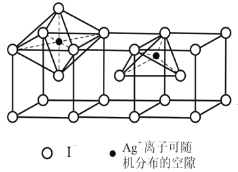
(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)= ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
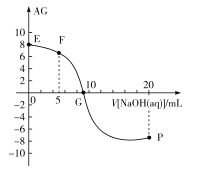
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol钠和1mol铝的混合物小心地投入932g水中,充分反应,计算:
(1)生成气体的质量为多少______?
(2)溶液中有几种溶质______?
(3)各溶质的质量分数为多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示___________,K值大小与温度的关系是:温度升高,K值_________(填一定增大、一定减小、或可能增大也可能减小)。
(2)对于可逆反应CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com