
(13分)绿矾(化学式FeSO4?7H2O)是硫酸法生产钛白粉的主要副产物,每生产1吨钛白粉,副产4.5~5.0吨绿矾,目前全国每年约副产绿矾75万吨,除极少量被用于制备新产品外,绝大部分作为废料弃去,对环境造成污染。因此开发综合利用绿矾的工艺,是一项很有意义的工作。某研究者提出如下图所示的绿色工艺流程。
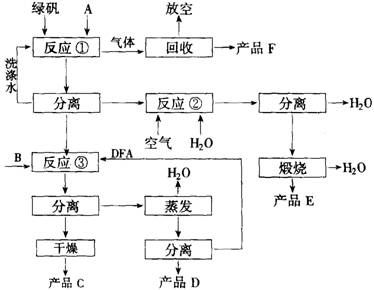
其中A是碳铵,B是氯化物,C是不含氯的优质钾肥,D是一种氮肥,E是红色颜料,F是常见的气体化合物。该工艺实现了原料中各主要成分的利用率均达94% 以上,可望达到综合利用工业废弃物和防治环境污染的双重目的。
9-1 写出B、C、D、E、F的化学式。
9-2 写出反应①、②、③的化学方程式。
9-3 指出反应③需要加入DFA(一种有机溶剂)的理由。
9-4 判断DFA是否溶于水。
科目:高中化学 来源: 题型:阅读理解
 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:实验题
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
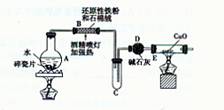
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
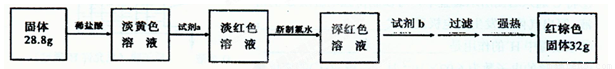
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com